Фенотипические проявления инсулинорезистентности у женщин репродуктивного возраста с ожирением и метаболическим синдромом
Цель. Выявить клинические и гормонально-метаболические проявления инсулинорезистентности (ИР) у женщин репродуктивного возраста с ожирением и метаболическим синдромом (МС).
Материалы и методы. Проведено одномоментное проспективное исследование по типу «случай-контроль» 537 женщин от 18 до 45 лет, средний возраст которых составил 33,0 [28,0; 37,0] года. Группу сравнения составили 130 женщин с окружностью талии <80 см и индексом массы тела (ИМТ) 18,5–24,9 кг/м2, в группу с ожирением включены 175 женщин с ИМТ≥30 кг/м2, группу с МС составили 232 человека. Лабораторное исследование крови проведено с определением глюкозы, холестерина, триглицеридов, липопротеидов высокой и низкой плотности, инсулина базального и стимулированного, С-реактивного белка (СРБ-hs), интерлейкина-6 (ИЛ-6), фактора некроза опухоли α (ФНО-α), фибриногена, индексов НОМА-IR и НОМА-β.
Результаты. Инсулинорезистентность выявлена значительно чаще у 85,8% женщин с МС, чем в группе сравнения (19,5%) и у лиц с ожирением (68,1%). Женщины с ожирением и МС в сочетании с ИР чаще имели избыточную массу тела и ожирение с детского/подросткового возраста (66,4%), раннее менархе (12,8±1,3 года), нарушения менструального цикла по типу олигоменореи (45,3%) и патологическую чрезмерную гестационную прибавку массы тела (55,6%). У женщин репродуктивного возраста с ожирением и МС в сочетании с ИР, по сравнению со здоровыми, регистрировались более высокие базальные и стимулированные значения глюкозы, снижение функциональной активности β-клеток поджелудочной железы, дислипидемия и повышение факторов воспаления, включая ФНО-α, фибриногена и ИЛ-6.
Заключение. ИР у женщин репродуктивного возраста с ожирением и МС ассоциирована с развитием гиперинсулинемии и прогрессирующим снижением функциональной активности β-клеток поджелудочной железы с клинической манифестацией нарушений углеводного обмена, дислипидемии, провоспалительного состояния и репродуктивной дисфункцией.
Ключевые слова: ожирение, инсулинорезистентность, метаболический синдром, репродуктивные нарушения.
Phenotypic manifestations of insulin in reproductive age women with obesity and metabolic syndrome
Aim. To identify clinical and hormonal-metabolic manifestations of insulin resistance in women of reproductive age with obesity and metabolic syndrome.
Materials and methods. A single-stage prospective case-control study included of 537 women from 18 to 45 years old, the mediane age was 33.0 [28.0; 37.0] years with obesity and metabolic syndrome. The comparison group consisted of 130 womens with a waist circumference <80 cm and BMI of 18.5–24.9 kg/m2, the obese group included 175 womens with a BMI≥30 kg/m2, the group with metabolic syndrome included 232 womens. Laboratory blood tests were carried out with the determination of cholesterol, triglycerides, HDL, LDL, glucose, insulin of basal and stimulated levels, IL-6, TNF-α, fibrinogen, also HOMA-IR and HOMA-β indices were calculated.
Results. Insulin resistance was detected significantly more often in 85.8% of women with MS than in the comparison group (19.5%) and in obese individuals (68.1%). Women with obesity and MS in combination with IR were more likely to have overweight and obesity from childhood/adolescence (66.4%), early menarche (12.8±1.3 years), menstrual irregularities of the oligomenorrhea type (45.3%), and pathological excessive gestational weight gain (55.6%). In women of reproductive age with obesity and MS in combination with IR compared with healthy women, higher basal and stimulated glucose values, a decrease in the functional activity of pancreatic β-cells, dyslipidemia, and an increase in inflammatory factors, including TNF-α, fibrinogen and IL-6.
Conclusion. Insulin resistance in women of reproductive age with obesity and metabolic syndrome is associated with the development of hyperinsulinemia and a progressive decrease in the functional activity of pancreatic β-cells with clinical manifestation of disorders of carbohydrate metabolism, dyslipidemia, proinflammatory state and reproductive dysfunction.
Key words: obesity, insulin resistance, metabolic syndrome, reproductive disorders.
Актуальность
По современным представлениям ожирение определяется как хроническое заболевание, характеризующееся избыточным накоплением жировой ткани в организме, представляющим угрозу здоровью, и являющееся основным фактором риска ряда других хронических заболеваний, включая сахарный диабет 2-го типа (СД 2) и сердечно-сосудистые заболевания (ССЗ), [1–3]. По результатам исследования ЭССЕ-РФ, проведенного на территории Российской Федерации, распространенность ожирения в возрасте 25–64 лет выше среди женщин в сравнении с мужчинами: при оценке по индексу массы тела (ИМТ) – 30,8% и 26,9% соответственно [4].
Экспертами Всемирной организации здравоохранения (ВОЗ) избыточная масса тела и ожирение признаны основными факторами риска преждевременной смертности в мире, являясь ежегодно причиной смерти 3,4 млн взрослых. Ожирение в 80% случаев и более приводит к СД 2, в 23% случаев связано с ишемической болезнью сердца и до 40% случаев ассоциировано с некоторыми видами онкологических заболеваний [5, 6]. Ожирение и ассоциированные с ним различные заболевания в настоящее время учеными и клиницистами рассматриваются в комплексе с учетом общности этих нарушений [7, 8]. Доказано, что избыточному накоплению висцеральной жировой ткани в организме сопутствуют инсулинорезистентность (ИР) и гиперинсулинемия, которые являются предикторами развития сердечно-сосудистых заболеваний, СД 2, атеросклероза, провоспалительного состояния и тромбообразования [9–11]. В 1988 г. профессор G.M. Reaven ввел в научную терминологическую систему понятие «метаболический синдром», объясняющий взаимосвязь ожирения, нарушения углеводного, липидного обменов и прогрессирование сердечно-сосудистой патологии [12]. Метаболический синдром (МС) представляет собой совокупность гормональных и метаболических нарушений, которые объединяет общий патофизиологический механизм – ИР [13, 14].
Согласно современным представлениям в основе МС находится состояние ИР, которое представляет собой нарушение биологического ответа периферических тканей организма на воздействие экзогенного или эндогенного инсулина. Снижение чувствительности к инсулину проявляется в регуляции метаболических реакций жиров, белков и углеводов, эндотелиальной функции и митогенных процессов. Резистентность к инсулину и гиперинсулинемия развиваются рано и протекают бессимптомно, значительно повышая суммарный риск развития неинфекционных заболеваний [6, 9, 15–21]. Имеющиеся результаты исследований в женской популяции демонстрируют, что частота метаболических факторов риска и риск смертности от кардиоваскулярной патологии у женщин значительно выше в отличие от мужчин [22–25]. В связи с этим важной задачей представляется раннее определение в клинической практике у женщин репродуктивного возраста проявлений ИР, лежащей в основе метаболического синдрома, для заблаговременной профилактики сердечно-сосудистых заболеваний и СД 2.
Цель исследования – выявить клинические и гормонально-метаболические проявления ИР у женщин репродуктивного возраста с ожирением и МС.
Материалы и методы
Работа выполнена на базе ГБОУ ВПО «Тюменский ГМУ» Минздрава России (ректор, чл.-кор. РАН И.В. Медведева) в соответствии с положениями Конституции Российской Федерации и Хельсинской декларации Всемирной медицинской ассоциации «Рекомендации для врачей, занимающихся биомедицинскими исследованиями с участием людей» при условии добровольного информированного согласия. Протокол исследования одобрен Комитетом по этике ФГБОУ ВО «Тюменский ГМУ» Минздрава России (от 14.09.2010 г.). Проведено одномоментное проспективное исследование по типу «случай-контроль» с участием 537 женщин от 18 до 45 лет, средний возраст которых составил 33,0 [28,0; 37,0] года.
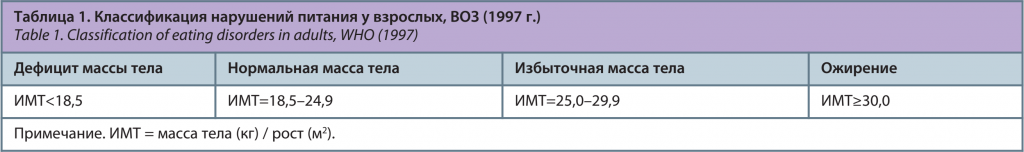
Обследование включало опрос (сбор жалоб и анамнеза), физикальный осмотр, антропометрическое обследование: измерение роста в положении стоя с помощью стандартного медицинского ростомера с точностью до 0,5 см; определение массы тела с помощью стационарных напольных электронных медицинских весов «МАССА-К» (Россия), с точностью измерения до 50 г; измерение окружности талии проводилось сантиметровой лентой в положении стоя на уровне I поясничного позвонка и пупка; измерение окружности бедер осуществлялось сантиметровой лентой в положении стоя на уровне больших вертелов тазобедренных костей. Диагностика нарушений питания у женщин проведена по классификации ВОЗ (1997 г.); табл. 1.
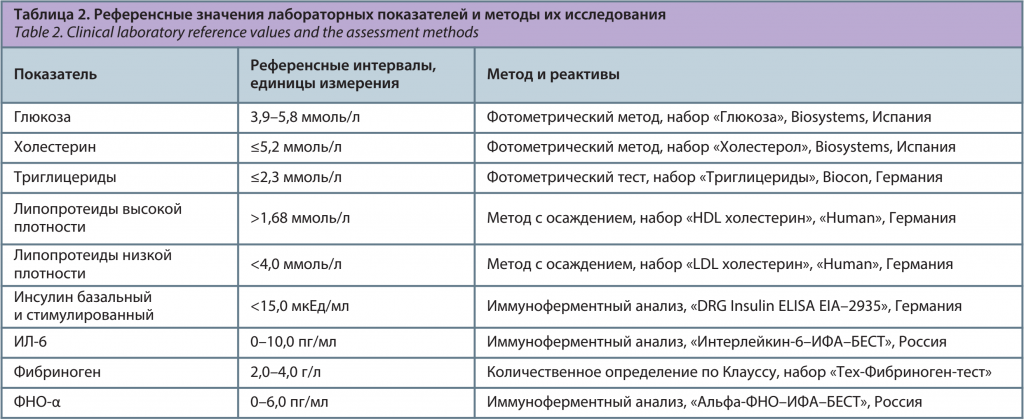
Определение типа распределения жировой ткани осуществлялось по индексу ОТ/ОБ (объем талии/объем бедер): глютео-феморальный тип распределения соответствовал индексу менее 0,85, абдоминальный тип распределения соответствовал индексу более 0,85 (ВОЗ, 1997 г.). Проведено измерение артериального давления (АД) с помощью тонометра на левой руке в положении сидя с расчетом среднего арифметического двух измерений. Оценка АД у женщин репродуктивного возраста с МС проводилась согласно критериям Международной федерации диабета (IDF) 2005 г. [26]. Лабораторная диагностика компонентов метаболического синдрома проводилась на полуавтоматическом биохимическом анализаторе «CLIMA MC–15» (Россия) в клинико-биохимической лаборатории Многопрофильной клиники ФГБОУ ВО «Тюменский ГМУ» Минздрава России (заведующая, канд. мед. наук Н.Ю. Южакова). Забор крови осуществлялся из локтевой вены в условиях процедурного кабинета после 10–12-часового голодания. Лабораторные показатели, референcные значения, а также методы их определения представлены в табл. 2.
Состояние углеводного обмена оценивалось по уровню глюкозы в крови утром натощак и результатам стандартного перорального глюкозотолерантного теста с использованием критериев диагностики нарушений углеводного обмена согласно критериям ВОЗ (1999 г., с дополнениями). Для оценки ИР и функциональной активности β-клеток поджелудочной железы применены методы математических моделей (индексов): индекс НОМА-IR (G0 × I0/ 22,5; норма <2,77, где G0 и I0 – концентрация глюкозы и инсулина натощак) и индекс функциональной активности β-клеток поджелудочной железы НОМА-β (20 × I0 / (G0 – 3,5); норма менее 180%. Верификация нарушений липидного обмена у женщин согласно критериям диагностики метаболического синдрома IDF, 2005 г. [26].
Согласно критериям включения и исключения сформированы три группы: группу сравнения составили 130 женщин с окружностью талии <80 см и ИМТ 18,5–24,9 кг/м2, в группу с ожирением включены 175 женщин с ИМТ≥30 кг/м2, группу с МС составили 232 человека, с ОТ≥80 см в сочетании с двумя и более параметрами, включая триглицериды ≥1,7 ммоль/л, липопротеиды высокой плотности ≤1,29 ммоль/л или лечение ранее диагностированной дислипидемии, АД≥130/85 мм рт. ст. или лечение ранее диагностированной артериальной гипертонии, глюкоза плазмы натощак ≥5,6 ммоль/л или лечение ранее диагностированного СД 2. Критериями исключения являлись декомпенсированные соматические заболевания, злокачественные новообразования, обострение очагов хронической инфекции, лечение глюкокортикостероидами, беременность и лактация, многоплодная беременность в анамнезе, пациентки с подтвержденным диагнозом «сахарный диабет 1-го типа», а также имеющие клинические симптомы вторичного диабета вследствие панкреатита, гемохроматоза и прочих заболеваний.
Материалы исследования статистически обработаны с применением пакета прикладных программ – Statistica v.10.0 (StatSoftInc, США). Для характеристики распределения количественных переменных использовали число наблюдений (n), среднее значение (М), среднеквадратическое отклонение (s), а также медианы (Ме), нижнего и верхнего квартилей при распределении отличном от нормального. При сравнительном анализе трех и более независимых выборок использован критерий Краскела–Уоллиса. При сравнительном анализе качественных показателей использован метод определения абсолютных и относительных частот, таблиц сопряженности, точного критерия Фишера и критерия χ2. Для определения ассоциации переменных использован метод ранговой корреляции Спирмена. Критический уровень значимости (р) при проверке статистических гипотез принимали равным 0,05.
Результаты и их обсуждение
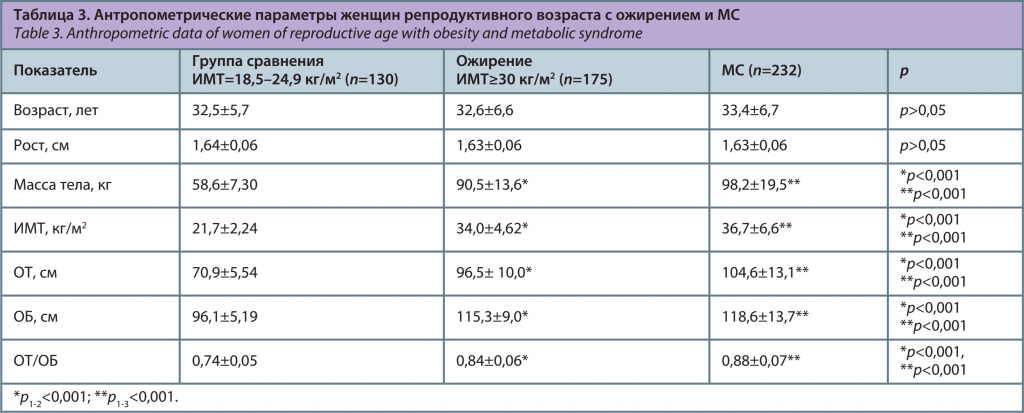
Из обследованных женщин в городских условиях проживали 76,9% (n=413), жительницы сельской местности составили 23,1% (n=124). Средний уровень образования имели 44,4% (n=238) женщин, высшее образование – 55,6% (n=299). Группы исследования не отличались по возрасту и ростовым показателям, но имели различия в показателях массы тела, ИМТ, ОТ, ОБ, а также индекса ОТ/ОБ (p<0,001), представленных в табл. 3.
Состояние ИР было выявлено в 19,5% (n=25) случаев в группе сравнения, у лиц с ожирением – в 68,1% (n=119), а при МС – у 85,8% женщин (n=199); p<0,001. При ожирении и ИР индекс НОМА-IR составил 3,7 [3,0; 4,6], при ожирении без ИР – 1,8 [1,3; 2,2], в группе сравнения без ИР значение индекса НОМА-IR составило 1,8 [1,3; 2,1]; p<0,001.
Для выявления особенностей проявления ИР у женщин репродуктивного возраста с ожирением и МС проведен анализ клинических показателей в зависимости от наличия ИР (табл. 4).
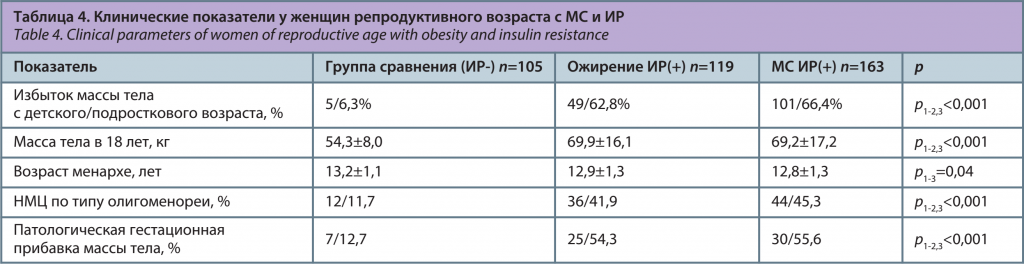
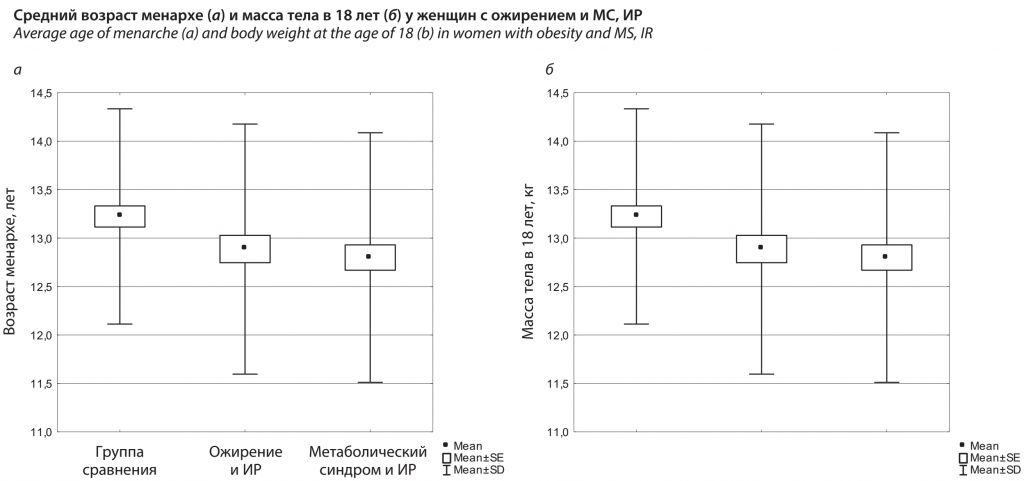
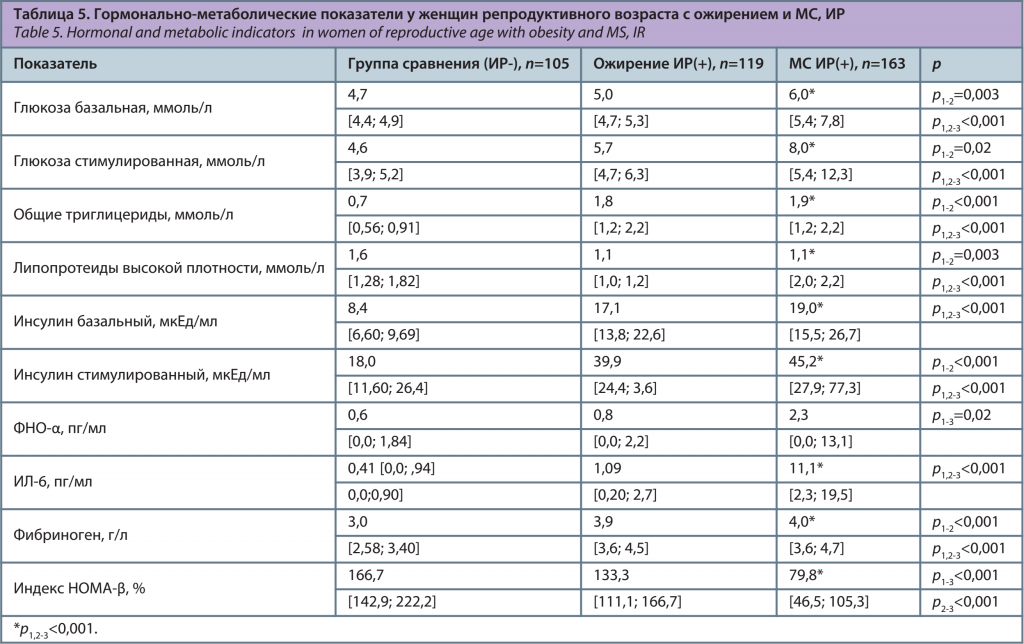
Женщины с ожирением и МС в сочетании с ИР чаще имели избыточную массу тела и ожирение с детского/подросткового возраста в 62,8% и 66,4% соответственно, в сравнении со здоровыми лицами без ИР (6,3%), χ2=56,3, p<0,001; χ2=77,6, p<0,001. В исследовании выявлено, что состояние ИР влияет на репродуктивную систему, в частности у женщин с МС в сочетании с ИР менархе наступило раньше в 12,8±1,3 года, чем в группе сравнения (13,2±1,1 года), p1-3=0,04. Средние значения массы тела в 18 лет при ожирении с ИР (69,9±16,1 кг) и МС с ИР (69,2±17,2 кг) были выше, чем у здоровых лиц (54,3±8,0 кг), p1-2,3<0,001 (см. рисунок).
Частота нарушений менструального цикла (НМЦ) по типу олигоменореи при ожирении и МС с ИР составила 41,9% и 45,3% и регистрировалась чаще в сравнении со здоровыми лицами (11,7%), χ2=21,0, p<0,001; χ2=26,5, р<0,001. Патологическая чрезмерная гестационная прибавка массы тела выявлена у каждой 2-й женщины с ожирением и МС при наличии ИР в 54,3% и 55,6%, в группе сравнения – в 12,7%, χ2=18,6, p<0,001; χ2=20,9, p<0,001.
Сравнительный анализ гормонально-метаболических параметров у женщин репродуктивного возраста показал ряд особенностей, характерных для лиц с ожирением и МС при наличии ИР, по сравнению со здоровыми лицами без ИР (табл. 5).
У женщин с ожирением и МС в сочетании с ИР по сравнению со здоровыми регистрировались более высокие базальные и стимулированные значения глюкозы (5,0 [4,7; 5,3] и 5,7 [4,7; 6,3] ммоль/л; 6,0 [5,4; 7,8] и 8,0 [5,4; 12,3] ммоль/л vs 4,7 [4,4; 4,9] и 4,6 [3,9; 5,2] ммоль/л), а также инсулина, (17,1 [13,8; 22,6] и 39,9 [24,4; 3,6] мкЕд/мл; 19,0 [15,5; 26,7] и 45,2 [27,9; 77,3] мкЕд/мл vs 8,4 [6,60; 9,69] и 18,0 [11,60; 26,4] мкЕд/мл), р<0,05.
Вместе с тем базальные и стимулированные уровни глюкозы оказались выше у женщин с МС и ИР, чем при ожирении с ИР; p<0,001. Максимальное содержание стимулированного инсулина регистрировалось в группе с МС и ИР, чем у лиц с ожирением и ИР; p<0,001. В исследовании установлено, что гиперинсулинемия у женщин репродуктивного возраста с МС и ИР сопровождается прогрессирующим снижением функциональной активности β-клеток поджелудочной железы до уровня 79,8% [46,5; 105,3] в 2,1 раза по сравнению со здоровыми (166,7 [142,9; 222,2] %) и в 1,7 раза с группой с ожирением и ИР (133,3 [111,1; 166,7] %); p<0,001.
У женщин с МС и ИР выявлены более высокие уровни триглицеридов (1,9 [1,2; 2,2] ммоль/л) и низкие значения липопротеидов высокой плотности (1,1 [2,0; 2,2] ммоль/л), чем в группе с ожирением и ИР (1,8 [1,2; 2,2]; 1,1 [1,0; 1,2] ммоль/л), а также в группе сравнения (0,7 [0,56; 0,91]; 1,6 [1,28; 1,82] ммоль/л); p<0,001. Кроме этого, у женщин с МС и ИР были выявлены отличия в содержании маркеров, отражающих состояние воспаления, включая фактор некроза опухоли – ФНО-α (2,3 [0,0; 13,1] пг/мл), интерлейкина-6 – ИЛ-6 (11,1 [2,3; 19,5] пг/мл) и фибриноген (4,0 [3,6; 4,7] г/л), содержание которых оказалось выше, чем у здоровых, у которых значения ФНО-α, ИЛ-6 и фибриногена составили 0,6 [0,0; 1,84] пг/мл, 3,0 [2,58; 3,40] пг/мл и 3,0 [2,58; 3,40] г/л соответственно; p=0,02, p<0,001, p<0,001. Причем наиболее высокие значения ИЛ-6 и фибриногена регистрировались у женщин с МС и ИР, чем в группе с ожирением и ИР (1,09 [0,20; 2,7] пг/мл и 3,9 [3,6; 4,5] г/л); р<0,001, p<0,001. Таким образом, получены результаты, свидетельствующие о связи ИР с развитием и прогрессированием провоспалительного состояния у женщин репродуктивного возраста с ожирением и МС.
Учитывая изложенное, следует заключить, что состояние ИР у женщин репродуктивного возраста с ожирением и МС характеризуется нарушениями углеводного и липидного обменов, развитием гиперинсулинемии и прогрессирующим снижением секреторной функции β-клеток поджелудочной железы, а также формированием провоспалительного статуса.
Заключение
Таким образом, ИР у женщин репродуктивного возраста с ожирением и МС ассоциирована с развитием гиперинсулинемии и прогрессирующим снижением функциональной активности β-клеток поджелудочной железы с клинической манифестацией нарушений углеводного обмена, дислипидемии, провоспалительного состояния и репродуктивной дисфункцией.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
- Must A, Spadano J, Coakley E et al. The disease burden associated with overweight and obesity. JAMA 1999; 282: 1523–9.
- Guh D, Zhang W, Bansback N et al. The incidence of co-morbidities related to obesity and overweight: a systematic review and meta-analysis. BMC Public Health 2009; 9: 88.
- Lenz M, Richter T, Muhlhauser I. The morbidity and mortality associated with overweight and obesity in adulthood: a systematic review. Dtsch Arztebl Int 2009; 106: 641–8.
- Баланова Ю.А., Шальнова С.А., Деев А.Д. и др. Ожирение в Российской популяции – распространенность и ассоциации с факторами риска хронических заболеваний. Рос. кардиол. журн. 2018; 23 (6): 123–30. DOI: 10.15829/1560-4071-2018-6-123-130 [Balanova Iu.A., Shal'nova S.A., Deev A.D. et al. Ozhirenie v Rossiiskoi populiatsii – rasprostranennost' i assotsiatsii s faktorami riska khronicheskikh zabolevanii. Ros. kardiol. zhurn. 2018; 23 (6): 123–30. DOI: 10.15829/1560-4071-2018-6-123-130 (in Russian).]
- Всемирная организация здравоохранения. Ожирение и избыточный вес. Информационный бюллетень. 2017; 311. http://www.who.int/mediacentre/factsheets/fs311/ru/ [Vsemirnaia organizatsiia zdravookhraneniia. Ozhirenie i izbytochnyi ves. Informatsionnyi biulleten'. 2017; 311. http://www.who.int/mediacentre/factsheets/fs311/ru/ (in Russian).]
- Global atlas on cardiovascular disease prevention and control 2011. Edited by S. Mendis, P. Puska, B. Norrving. World Health Organization, 2013.
- Ожирение: этиология, патогенез, клинические аспекты. Под ред. И.И. Дедова, Г.А. Мельниченко. М.: Медицинское информационное агентство, 2006. [Ozhirenie: etiologiia, patogenez, klinicheskie aspekty. Ed I.I. Dedov, G.A. Mel'nichenko. Moscow: Meditsinskoe informatsionnoe agentstvo, 2006 (in Russian).]
- Sesti G. Pathophysiology of insulin resistance. Best Pract Res Clin Endocrinol Metab 2006; 20: 665–79.
- Johnson AM, Olefsky JM. The origins and drivers of insulin resistance. Cell 2013; 152 (4): 673–84.
- Ferrannini E et al. Insulin resistance and hypersecretion in obesity. European Group for the Study of Insulin Resistance (EGIR). J Clin Invest 1997; 100: 1166–73.
- Ткачук В.А., Воротников А.В. Молекулярные механизмы развития резистентности к инсулину. Сахарный диабет. 2014; 2: 29–40. [Tkachuk V.A., Vorotnikov A.V. Molekuliarnye mekhanizmy razvitiia rezistentnosti k insulinu. Sakharnyi diabet. 2014; 2: 29–40 (in Russian).]
- Himsworth HP, Kerr RB. Insulin-sensitive and insulin-insensitive types of diabetes mellitus. Gin Sci 1939; 4: 119–52.
- Alberti KG, Zimmet P, Shaw J. Metabolic syndrome – a new world-wide definition: A Consensus Statement from the International Diabetes Federation. Diabet Med 2006; 23: 469–80.
- Мкртумян А.М. Метаболический синдром: конфликт провоспалительных цитокинов. Эффективная фармакотерапия. 2012; 46: 12–5. [Mkrtumian A.M. Metabolicheskii sindrom: konflikt provospalitel'nykh tsitokinov. Effektivnaia farmakoterapiia. 2012; 46: 12–5 (in Russian).]
- Гордюнина С.В. Инсулинорезистентность и регуляция метаболизма. Проблемы эндокринологии. 2012; 3 (58): 31–4. [Gordiunina S.V. Insulinorezistentnost' i reguliatsiia metabolizma. Problemy endokrinologii. 2012; 3 (58): 31–4 (in Russian).]
- Демидова Т.Ю. Этиопатогенетическая роль инсулинорезистентности в развитии метаболических и сосудистых нарушений при сахарном диабете 2 типа. Фарматека. 2010; 16: 18–24. [Demidova T.Iu. Etiopatogeneticheskaia rol' insulinorezistentnosti v razvitii metabolicheskikh i sosudistykh narushenii pri sakharnom diabete 2 tipa. Farmateka. 2010; 16: 18–24 (in Russian).]
- Лавренова Е.А., Драпкина О.М. Инсулинорезистентность при ожирении: причины и последствия. Ожирение и метаболизм. 2020; 17 (1): 48–55. [Lavrenova E.A., Drapkina O.M. Insulinorezistentnost' pri ozhirenii: prichiny i posledstviia. Ozhirenie i metabolizm. 2020; 17 (1): 48–55 (in Russian).]
- Порядин Г.В., Осколок Л.Н. Патофизиологические аспекты метаболического синдрома. Лечебное дело. 2011(4): 4–10. [Порядин Г.В., Осколок Л.Н. Патофизиологические аспекты метаболического синдрома. Лечебное дело. 2011(4): 4–10 (in Russian).]
- Ройтберг Г.Е. Метаболический синдром. М.: МЕДпресс-информ, 2007. [Roitberg G.E. Metabolicheskii sindrom. Moscow: MEDpress-inform, 2007 (in Russian).]
- Legro RS. Insulin resistance in women's health: why it matters and how to identify it. Curr Opin Obstet Gynecol 2009; 21 (4): 301–5.
- Samy IM, Banerji M, Sowers RJ. Insulin resistance and cardiovascular disease. J Clin Endocrinol Metab 2001; 86: 713–8.
- Мычка В.Б. Женское сердце. М.: Формат печати, 2012. [Mychka V.B. Zhenskoe serdtse. Moscow: Format pechati, 2012 (in Russian).]
- Прилепская В.Н., Цаллагова Е.В. Ожирение: клиника, диагностика, лечение. М.: МЕДпресс-информ, 2007. [Prilepskaia V.N., Tsallagova E.V. Ozhirenie: klinika, diagnostika, lechenie. Moscow: MEDpress-inform, 2007 (in Russian).]
- Рекомендации по диабету, предиабету и сердечно-сосудистым заболеваниям EASD/ESC. Рос. кардиол. журн. 2014; 3 (107): 7–61. [Rekomendatsii po diabetu, prediabetu i serdechno-sosudistym zabolevaniiam EASD/ESC. Ros. kardiol. zhurn. 2014; 3 (107): 7–61 (in Russian).]
- Рекомендации экспертов Всероссийского научного общества кардиологов по диагностике и лечению метаболического синдрома. Второй пересмотр. Кардиоваскулярная терапия и профилактика. 2009; 6 (Прил. 2): 1–29. [Rekomendatsii ekspertov Vserossiiskogo nauchnogo obshchestva kardiologov po diagnostike i lecheniiu metabolicheskogo sindroma. Vtoroi peresmotr. Kardiovaskuliarnaia terapiia i profilaktika. 2009; 6 (Pril. 2): 1–29 (in Russian).]
- The IDF consensus worldwide definition of the metabolic syndrome. International Diabetes Federation, 2006.
