Лечение дислипидемии у больных с кардиометаболическим синдромом
Кардиометаболический (или метаболический, КМС) синдром характеризуется увеличением массы висцерального жира, снижением чувствительности периферических тканей к инсулину (инсулинорезистентностью) и гиперинсулинемией, которые сопровождаются артериальной гипертонией и нарушениями углеводного, пуринового и липидного обменов. Распространенность КМС среди взрослого населения планеты составляет 10–30%, в России 20–35%, причем с возрастом число больных увеличивается. У 80% пациентов с КМС имеется дислипидемия. В статье представлены подходы к ведению пациентов с дислипидемией, особенности немедикаментозной терапии, целевые уровни липидов, выбор препаратов в соответствии с данными доказательной медицины.
Ключевые слова: дислипидемия, метаболический синдром, кардиометаболический синдром, инсулинорезистентность, синдром Х, рекомендации, профилактика, медикаментозная терапия сердечно-сосудистых событий, немедикаментозная терапия, препараты выбора, коморбидность, прогноз, смертность, выживаемость, статины.
Treatment of dyslipidemia in patients with cardiometabolic syndrome
Abstrаct
Cardiometabolic syndrome (CMS) is characterized by an increase in the mass of visceral fat, decreased sensitivity of peripheral tissues to insulin (insulin resistance) and hyperinsulinemia, which cause disorders of carbohydrate, lipid, purine metabolism and AH. The prevalence of CMS among the adult population of the planet is 10–30%, in Russia 20–35%, and the number of patients increases with age. Dyslipidemia is an component of the cardiometabolic syndrome in 80% of patients. The approaches to the management of patients with dyslipidemia, aspects of non-drug therapy, target lipid levels, and the choice of drugs in accordance with evidence-based medicine are presented in this article.
Key words: dyslipidemia, metabolic syndrome, cardiometabolic syndrome, insulin resistance, syndrome X, recommendations, prevention, drug therapy, cardiovascular events, non-drug therapy, drugs of choice, comorbidity, prognosis, mortality, survival, statin.
Введение
Дислипидемия представляет собой ведущий фактор риска развития атеросклероза и связанных с ним сердечно-сосудистых заболеваний (ССЗ) [1]. Около 80% пациентов с кардиометаболическим синдромом (КМС) имеют дислипидемию [2].
Определение дислипидемии
Дислипидемия включает в себя широкий спектр нарушений липидного обмена [1], из которых часто встречается повышение концентрации в крови холестерина (ХС) липопротеидов низкой плотности (ЛПНП), триглицеридов (ТГ) и снижение ХС липопротеидов высокой плотности (ЛПВП) [2]. Эти нарушения составляют липидную триаду. Однако наряду с ней встречаются и другие нарушения липидного обмена, в том числе изолированное повышение уровня ТГ, изолированное снижение уровня ХС ЛПВП, гиперхолестеринемия и др. [1].
Дислипидемия при КМС представляет собой комплекс нарушений липидного обмена, включая тощаковое и постпрандиальное повышение уровня ТГ, высокий уровень аполипопротеина В (апоВ) и ХС ЛПНП, низкий уровень ХС ЛПВП и аполипопротеина А1 (апоА1) [4]. Увеличение окружности талии (ОТ) и повышенный уровень ТГ являются простыми признаками, позволяющими выделить пациентов с КМС среди пациентов с дислипидемией [4].
Скрининг дислипидемии при метаболическом синдроме
Скрининг на дислипидемию показан пациентам с ССЗ, сахарным диабетом (СД), хронической болезнью почек (ХБП), цереброваскулярными заболеваниями (инсультом, транзиторной ишемической атакой), болезнями периферических артерий, мужчинам в возрасте старше 40 лет, женщинам в возрасте старше 50 лет или после наступления менопаузы, особенно при наличии других факторов риска, больным с хроническими аутоиммунными воспалительными заболеваниями (ревматоидный артрит, системная красная волчанка, псориаз), пациентам с клиническими проявлениями атеросклероза и/или наследственных дислипидемий (ксантомами, ксантелазмами, липоидной дугой роговицы в возрасте до 45 лет), а также пациентам с КМС [4].
Базовая оценка липидного спектра предполагает определение уровня общего ХС, ТГ, ХС ЛПВП и ХС ЛПНП. Для дополнительного анализа липидов крови можно использовать уровень неЛПВП (рассчитывают, как ХС ЛПВП), липопротеина, соотношение апоВ/апоА1, которые являются такими же хорошими маркерами риска, как традиционные параметры липидного обмена [3, 4].
Классификация дислипидемий
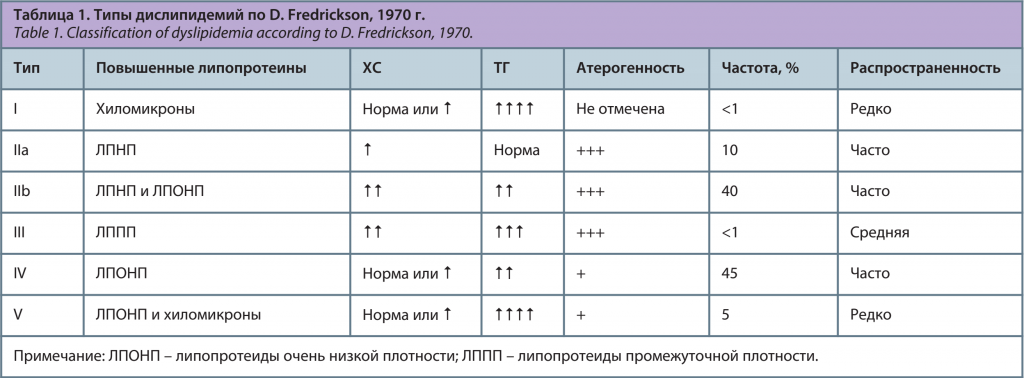
В соответствии с классификацией Всемирной организации здравоохранения, выделяют пять типов дислипидемии (табл. 1). Эта классификация позволяет определить риск развития атеросклероза [1].
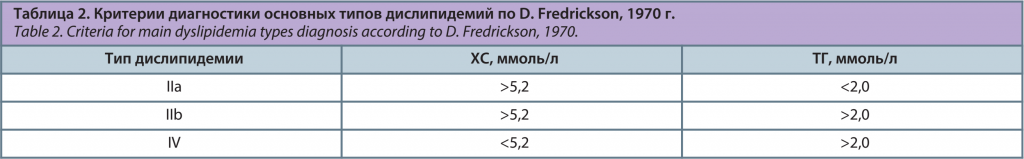
В Европейских рекомендациях по дислипидемии 2016 г. она не приводится, но сохраняется в Российских рекомендациях 2017 г. Наиболее атерогенными являются IIa, IIb и IV типы дислипидемий [1]. Упрощенный алгоритм их диагностики возможен по уровням ХС и ТГ (табл. 2). Типы I, III, V являются «относительно» атерогенными [1].
Лечение дислипидемии при метаболическом синдроме
Немедикаментозное лечение. Краеугольным камнем лечения КМС являются немедикаментозные мероприятия, т.е. формирование так называемого здорового образа жизни. Присоединение медикаментозных методов лечения не исключает немедикаментозных мероприятий, а должно проводиться параллельно.
Немедикаментозное лечение является более физиологичным, доступным и не требует больших материальных затрат. Однако необходимы значительные усилия со стороны врачей и самого больного, так как проведение данного вида лечения связано с затратами дополнительного времени. Эти мероприятия должны проводиться пожизненно и включают в себя:
• умеренно гипокалорийную диету с низким содержанием жиров <30%, насыщенных жиров – менее 10% от общего калоража, соли – менее 5 г/сут (особенно за счет уменьшения потребления засоленных продуктов), с упором на зерновые, овощи, фрукты, рыбу, бобовые, орехи и ведением дневника питания;
• повышение физической активности: необходимо 2,5–5,0 ч умеренной физической активности в неделю или 30–60 мин в день;
• отказ от употребления табака и курения в любой форме;
• отказ от злоупотребления алкоголем;
• снижение массы тела до показателя индекса массы тела (ИМТ) 18–25 кг/м2, ОТ<94 см у мужчин и ОТ<80 cм – у женщин [1, 4, 5].
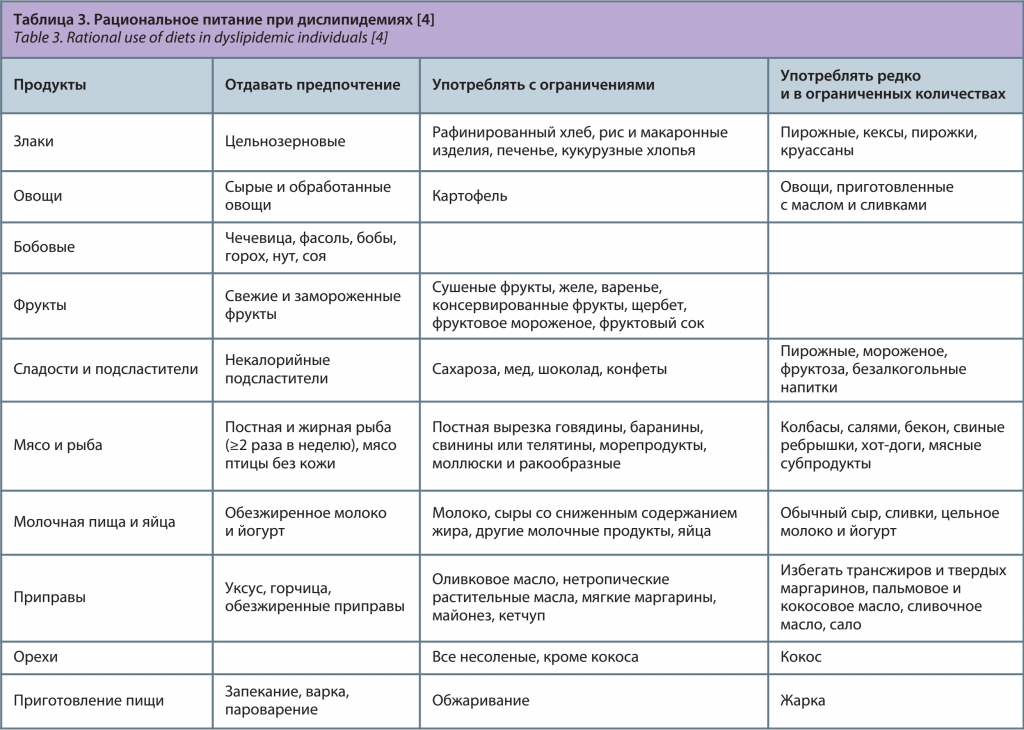
Основным и наиболее физиологичным методом лечения считают рациональное питание (табл. 3). Оно включает в себя не только употребление «полезных» и исключение «вредных» продуктов, рациональный режим приема пищи, правильное сочетание продуктов, способы приготовления пищи без жиров, но и определенное поведение в процессе каждого приема пищи [5].
Наиболее изученными и доказавшими свою эффективность диетическими подходами являются DASH (Dietary Approaches to Stop Hypertension – диетические подходы к «Стоп гипертония») и средиземноморская диета. Они характеризуются высоким содержанием фруктов, овощей и цельнозерновых продуктов, частым употреблением бобовых, орехов, рыбы, птицы, молочных продуктов с низким содержанием жира и ограничением потребления сладостей, подслащенных напитков и красного мяса, содержат значительную долю диетических жиров не из тропических масел и не из животных источников. Значимым различием между этими двумя диетами является преобладание оливкового масла в средиземноморской диете. Особое внимание рациональному питанию должны уделять не только лица, уже страдающие ожирением, но и те, у кого имеется наследственная предрасположенность к ожирению, СД, артериальной гипертонии и атеросклерозу. В этом случае правильное питание будет служить средством профилактики развития этих заболеваний [3].
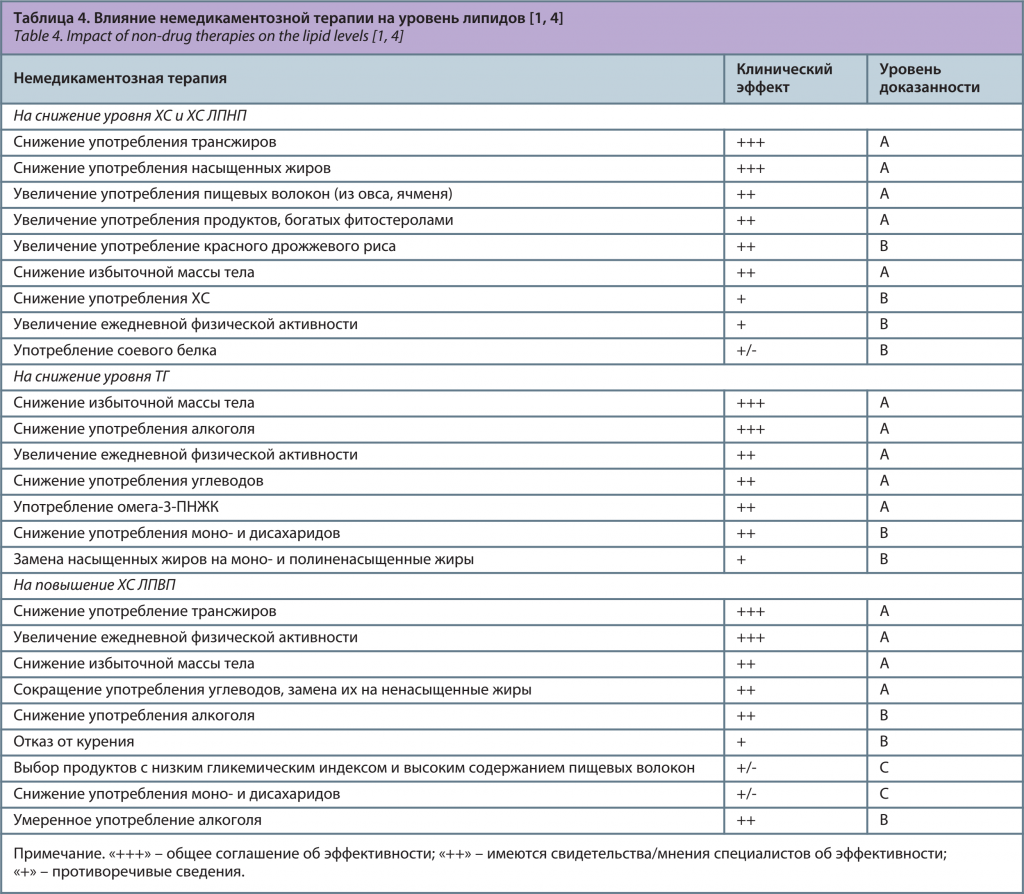
Немедикаментозная терапия может оказать существенное влияние на уровень липидов (табл. 4). Ни в коем случае нельзя допускать голодания, потому что при этом клетки тканей человека не получают глюкозу – основной источник энергии и переходят на альтернативный источник питания – жиры. В результате распада собственных жировых депо происходит накопление свободных жирных кислот, а их избыток разрушается с образованием кетоновых тел. Необходимо рекомендовать больному такое ограничение суточной калорийности, которое пациент сможет соблюдать пожизненно без постоянного чувства голода, снижения настроения и ухудшения самочувствия [5].
Для снижения уровня ХС и ХС ЛПНП и увеличения ХС ЛПВП необходимо снизить употребление трансжиров. Трансжиры – это жиры с измененной структурой, произведенные промышленно из растительных жиров. Они содержатся в маргарине, чипсах, выпечке, продуктах, жаренных в масле [4].
Кроме того, для снижения уровня ХС и ХС ЛПНП необходимо увеличить употребление продуктов, богатых фитостеролами. К фитостеролам относятся ситостерол, кампестерол, стигмастерол. Они встречаются в природе в растительных маслах и в небольших количествах в овощах, свежих фруктах, орехах, зерновых и бобовых культурах. Фитостеролы конкурируют с ХС за всасывание в кишечнике и, следовательно, снижают уровень ХС в крови [4].
Для снижения уровня ХС и ХС ЛПНП необходимо увеличить употребление красного дрожжевого риса. Он является источником ферментированного пигмента, который используется в Китае как пищевой краситель и усилитель вкуса в течение многих столетий. Красный рис, как и статины, ингибирует фермент гидроксиметилглутарил-коэнзим А (ГМГ-КоА) редуктазу, снижает ХС и ХС ЛПНП, но в долгосрочной перспективе безопасность регулярного потребление его не документирована [4].
С целью уменьшения уровня ТГ целесообразно увеличить употребление омега-3-полиненасыщенных жирных кислот (омега-3-ПНЖК). Они содержатся в рыбе, орехах, сое, льняном масле. В виде лекарственного препарата в дозе 2–3 г/сут они снижают ТГ до 30%, но могут увеличить ХС ЛПНП. После получения результатов последних исследований с целью вторичной профилактики ССЗ они не рекомендуются [4].
Для коррекции дислипидемии у больных с КМС очень важно повышение физической активности, которое следует расценивать как необходимую часть программы по снижению массы тела. Известно, что повышение физической активности не только способствует большей потере массы тела, но и позволяет сохранить достигнутый результат. Самый простой, но достаточно эффективный способ повысить физическую активность – это ходьба. Причем важен не темп ходьбы, а пройденное расстояние. Врачу необходимо выяснить предпочтения пациента и, исходя из этого, рекомендовать тот или иной вид физических нагрузок [5].
Медикаментозное лечение дислипидемии. К назначению гиполипидемической терапии пациентам с КМС необходимо подходить индивидуально с учетом степени СС риска.
Оценка сердечно-сосудистого риска. При определении СС риска можно использовать систему SCORE (Systematic Coronary Risk Evaluation, систематическая оценка коронарного риска), которой можно воспользоваться на сайте www.heartscore.org. Эта система учитывает 5 факторов риска (пол, возраст, систолическое артериальное давление – АД, ХС крови и курение) и позволяет рассчитать риск развития смертельного сердечно-сосудистого (СС) события в течение 10 лет.
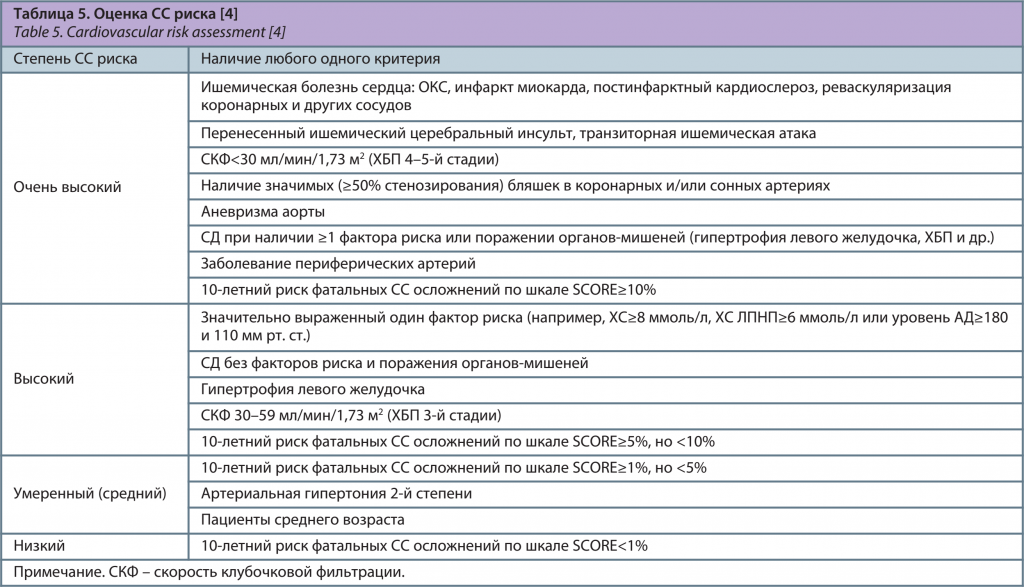
Российская Федерация относится к странам высокого СС риска, для которых используется отдельный вариант шкалы SCORE. Показатель СС риска <1% расценивается как низкий, риск ≥1% и <5% – как умеренный (средний), риск ≥5 и <10% – как высокий и риск ≥10% – как очень высокий [4].
Пациентам с наличием диагностированного ССЗ (ишемическая болезнь сердца: инфаркт миокарда, острый коронарный синдром – ОКС, постинфарктный кардиосклероз, реваскуляризация сосудов и т.д.), цереброваскулярного заболевания (инсульт, транзиторная ишемическая атака), ХБП, СД, гипертрофии левого желудочка или выраженным повышением какого-либо фактора риска (например, ХС≥8 ммоль/л, ХС ЛПНП≥6 ммоль/л или АД≥180 и 110 мм рт. ст.) проводить оценку риска по шкале SCORE не нужно. Такие пациенты должны автоматически расцениваться как больные высокого или очень высокого риска (табл. 5), и требуют интенсивной коррекции различных факторов риска, в том числе дислипидемии [3].
У всех пациентов с КМС с учетом критериев его диагностики есть абдоминальное ожирение и 2 дополнительных критерия диагностики, т.е. имеется минимум 3 фактора риска. В связи с этим большинство пациентов с КМС являются пациентами высокого или очень высокого СС риска.
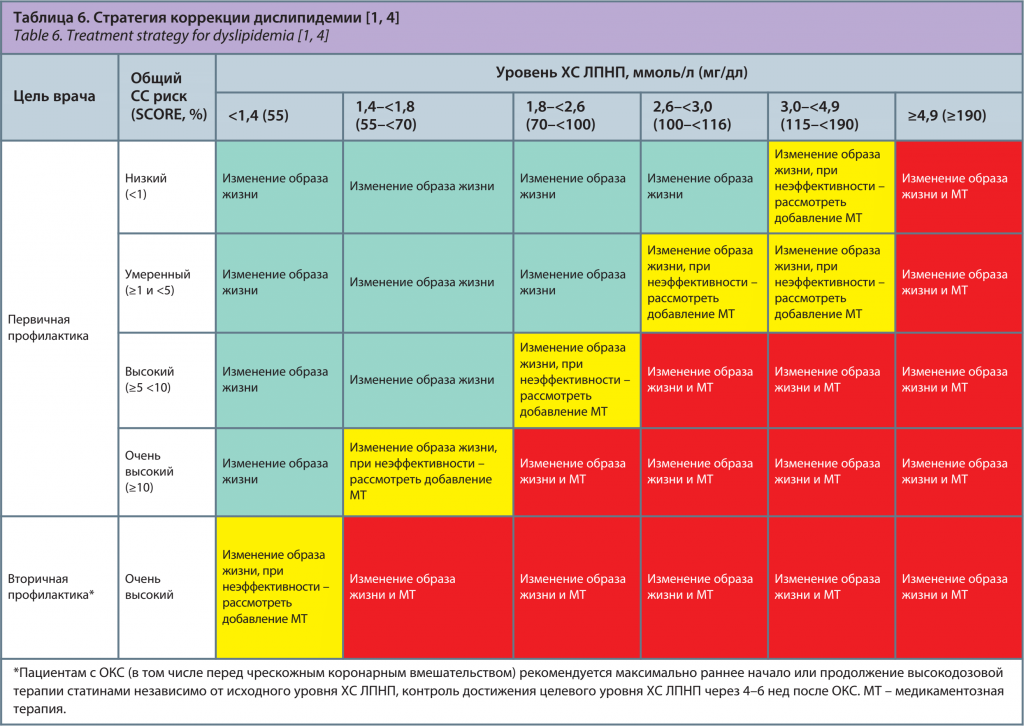
Стратегия коррекции дислипидемии в зависимости от СС риска и уровня ХС ЛПНП. Подходы к коррекции дислипидемии зависят от степени СС риска, уровня ХС ЛПНП (табл. 6) [1, 4] и цели медикаментозного лечения.
Целевые уровни липидов для профилактики сердечно-сосудистых заболеваний
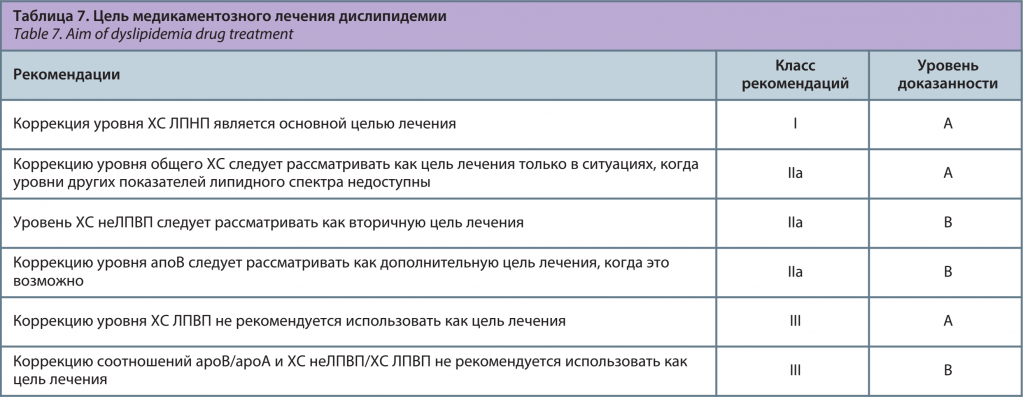
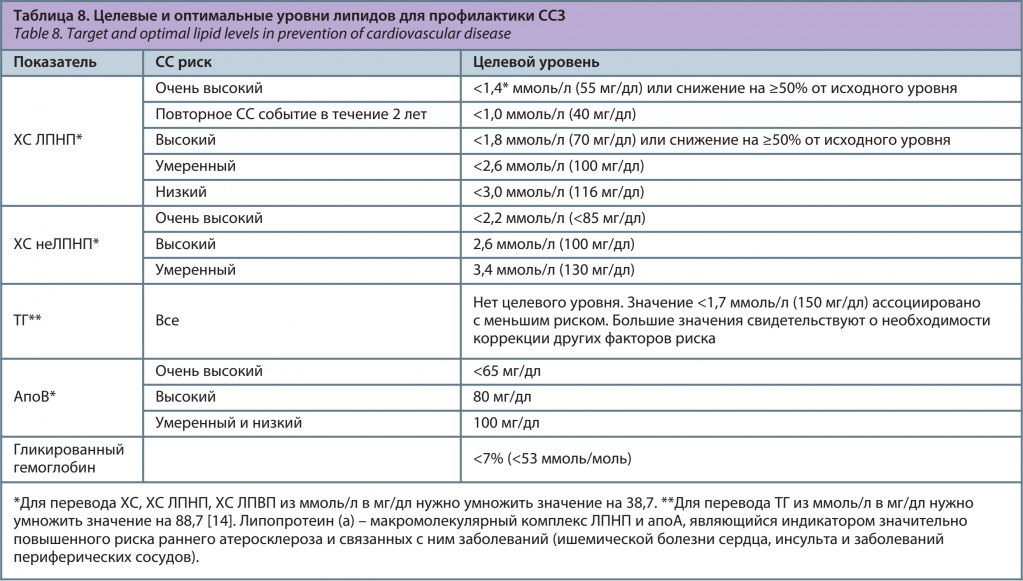
В настоящее время ведущую роль при решении вопроса о начале медикаментозной терапии и оценке ее эффективности имеет ХС ЛПНП (табл. 7) [1]. Это связано с тем, что при уменьшении уровня ХС ЛПНП на каждый 1 ммоль/л смертность от всех причин снижается на 10–14%, смертность от ССЗ – на 20–27%, риск развития коронарных осложнений – на 23–27%, инсульта – на 17–22%. Это наблюдается уже в первый год лечения, в последующие годы выраженность этих изменений еще более увеличивается. Клиническая эффективность гиполипидемической терапии зависит, главным образом, не от типа статина, а от степени снижения ХС ЛПНП [4]. В табл. 8 представлены целевые и оптимальные уровни липидов для профилактики ССЗ [1, 4].
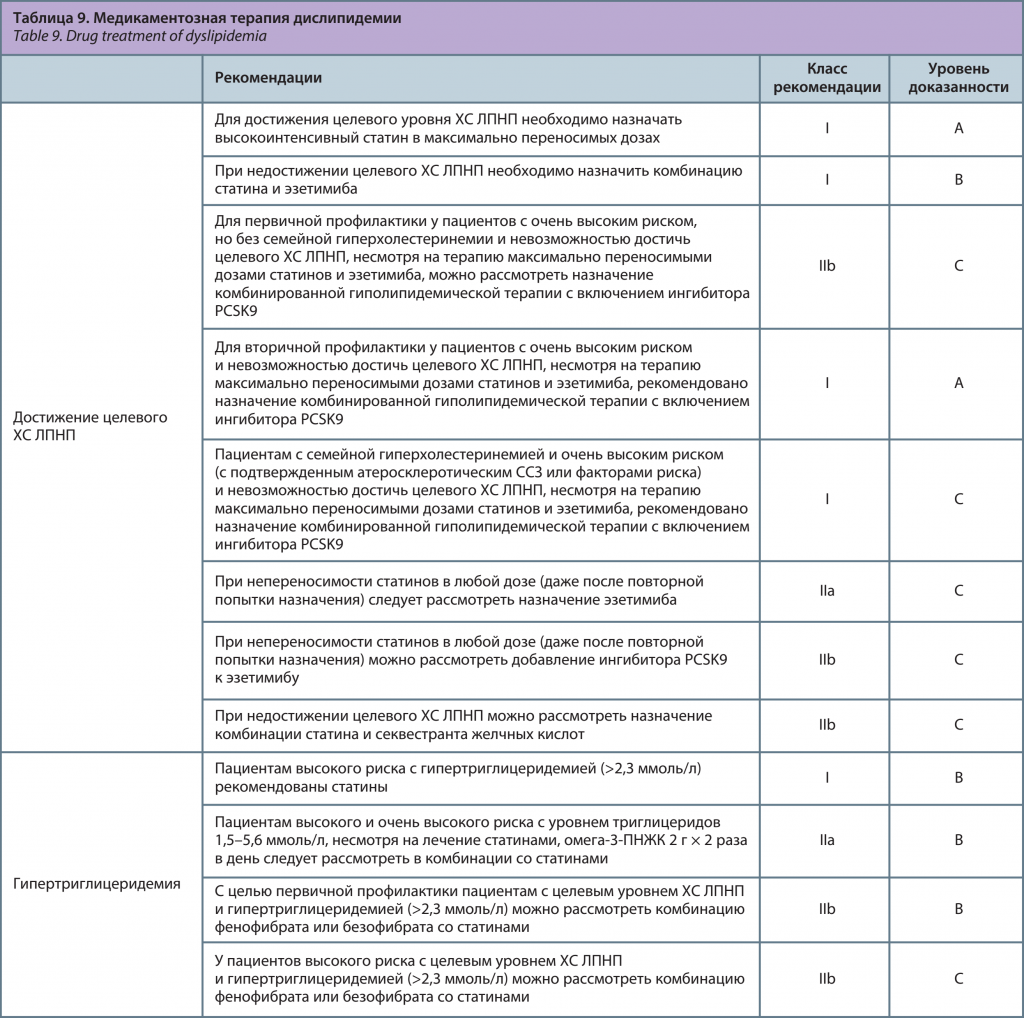
К средствам медикаментозной терапии дислипидемий относятся статины, ингибиторы всасывания ХС в кишечнике, ингибиторы протеиновой конвертазы субтилизин-кексинового типа 9 (PCSK9), фибраты. Секвестранты желчных кислот и никотиновая кислота замедленного высвобождения отсутствуют в российских рекомендациях [1]. Алгоритм назначения медикаментозной терапии представлен в табл. 9.
В настоящее время гиполипидемическими препаратами выбора в первичной и вторичной профилактике ССЗ больных с КМС являются статины. Они уменьшают синтез ХС в печени за счет ингибирования активности фермента ГМГ-КоА-редуктазы. При этом снижение внутриклеточной концентрации ХС повышает экспрессию рецепторов ХС ЛПНП на поверхности гепатоцитов и приводит к уменьшению концентрации циркулирующего ХС ЛПНП и других липопротеидов, содержащих апоВ [4]. Статины снижают уровень ТГ на 30–50% и увеличивают ХС ЛПВП на 5–10% [4].
Результаты многочисленных клинических исследований свидетельствуют, что статины значительно снижают заболеваемость и смертность от ССЗ во всех возрастных группах как у мужчин, так и у женщин. Статины замедляют прогрессирование и вызывают регрессию атеросклероза коронарных артерий [1]. Их широкое применение при лечении дислипидемии у этой категории больных оправдано тем, что они обладают наиболее выраженным и мощным гипохолестеринемическим действием, имеют наименьшее число побочных эффектов и хорошо переносятся больными. Они не влияют на показатели углеводного обмена и не взаимодействуют с гипогликемическими препаратами [5].
В Российской Федерации представлены аторвастатин в дозах 10, 20, 30, 40 и 80 мг, розувастатин – в дозах 5, 10, 15, 20 и 40 мг, питавастатин – в дозах 1, 2 и 4 мг, симвастатин – в дозах 10, 20 и 40 мг, флувастатин – в дозах 40 мг и 80 мг.
Максимальное снижение ХС ЛПНП на 50–55% возможно при применении высоких доз аторвастатина и розувастатина [1].
Лечение статинами назначают с небольших доз, постепенно титруя дозу до достижения целевого уровня. Статины переносятся хорошо, однако могут вызывать диспепсические расстройства в виде запоров, метеоризма, болей в животе. В 0,5–2,0% случаев отмечается повышение печеночных ферментов в крови [5]. Прогрессирование повреждений с развитием печеночной недостаточности наблюдается исключительно редко [4].
В 0,1–0,5% случаев на фоне терапии статинами наблюдаются миопатии и миалгии. Рабдомиолиз, или распад мышечной ткани, является самой тяжелой формой статин-индуцированной миопатии [4]. Он сопровождается выраженной миалгией, повышением креатинфосфокиназы (КФК) более чем в 10 раз (часто до 40 раз), потемнением цвета мочи из-за миоглобинурии, почечной недостаточностью, может привести к смерти [5].
Нейрокогнитивные влияния статинов, в том числе связь с болезнью Альцгеймера, не были подтверждены в анализах большой популяции пациентов и в метаанализах [4].
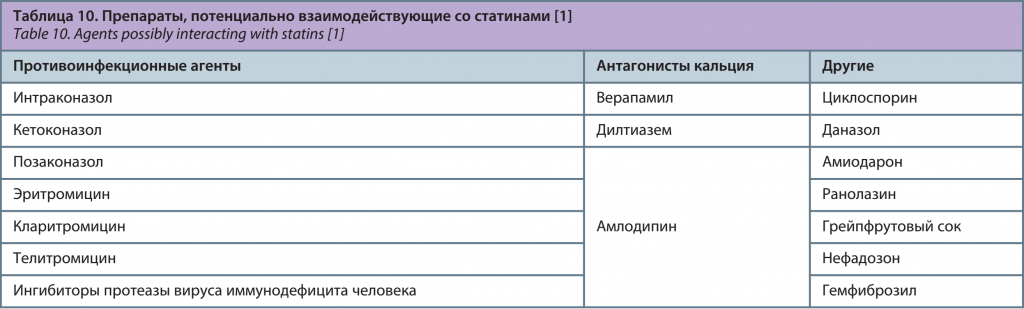
Ряд препаратов может потенциально взаимодействовать со статинами, в связи с этим необходимо избегать совместного назначения или назначать их с осторожностью (табл. 10). Питавастатин имеет минимальный спектр взаимодействий [1].
Эзетимиб ингибирует всасывание ХС в кишечнике путем взаимодействия с белком NPC1L1 (Niemann-Pick C1-like protein 1, подобный белку Niemann-Pick 1), не влияя на всасывание других жирорастворимых веществ. При этом снижается количество ХС, которое поступает в печень. Это способствует повышению экспрессии рецепторов ХС ЛПНП на поверхности гепатоцитов и, следовательно, снижению концентрации циркулирующего ХС ЛПНП [4]. Рекомендуемая доза 10 мг/сут. Можно назначать в комбинации с любым статином в любой дозе. О развитии серьезных нежелательных явлений не сообщалось. Наиболее частыми побочными эффектами являются умеренное повышение уровня печеночных ферментов и миалгии [4].
В Российской Федерации одобрены к применению два представителя этого класса эволокумаб в дозировке 140 мг и алирокумаб в дозировке 75 мг и 150 мг в шприц-ручке. Препарат вводится подкожно 1–2 раза в месяц. Оба препарата снижают ХС ЛПНП на 60% и липопротеин (а) на 30%. У больных высокого риска при недостижении целевого уровня ХС ЛПНП эволокумаб в комбинации с умеренной или высокодозовой терапией статинами приводил к дополнительному снижению риска развития СС осложнений на 15–20%. Аналогичные данные получены для алирокумаба [1]. К наиболее частым побочным эффектам относятся зуд в месте инъекции и симптомы простуды [4].
Ингибиторы PCSK9 являются моноклональными антителами к пропротеиновой конвертазе субтилизин-кексинa типа 9, которая играет ключевую роль в разрушении рецепторов ХС ЛПНП в печени. В клинических исследованиях они показали возможность выраженного снижения ХС ЛПНП и СС риска у больных с ишемической болезнью сердца [1]. О значительном влиянии на ХС ЛПВП и ТГ не сообщалось [4].
Способность фибратов снижать ТГ, повышать ХС ЛПВП, активность липопротеидлипазы и усиливать действие гипогликемических препаратов делает их ценными в лечении дислипидемии при КМС. Фибраты хорошо переносятся, однако в 5–10% случаев могут вызывать диспепсические расстройства в виде запоров, диареи, метеоризма. Эти нежелательные явления, как правило, протекают в легкой форме и не требуют отмены лечения. Не рекомендуется принимать фибраты при желчнокаменной болезни [5]. Комбинация статинов с фибратами может увеличить риск развития миопатии. Этот риск наиболее высок у гемфиброзила, поэтому назначения его со статинами необходимо избегать. Повышение риска развития миопатии при совместном использовании статинов с другими фибратами (фенофибрат, безафибрат, ципрофибрат) является незначительным [4].
Секвестранты желчных кислот (холестирамин, колестипол, келесевелам) представляют собой ионообменные смолы, которые не всасываются в системный кровоток, связывают желчные кислоты в кишечнике, препятствуют их обратному всасыванию и возвращению в печень, способствуют их выведению. Печень, в которой истощаются запасы желчных кислот, начинает их активно синтезировать из ХС. Это приводит к компенсаторному увеличению активности рецепторов ХС ЛПНП, удалению ХС ЛПНП из системного кровотока и снижению их уровня в крови на 18–25%. Влияния на уровень ХС ЛПВП не наблюдалось, а уровень ТГ может повышаться у некоторых пациентов, особенно с гипертриглицеридемией [4]. Побочные эффекты – метеоризм, задержка стула, диспепсия, тошнота, выражены минимально при начале лечения с малых доз и запивании большим количеством воды [4]. Могут снижать всасывание жирорастворимых витаминов и лекарственных препаратов, поэтому их следует принимать за 4 ч до или через 1 ч после приема препарата [4].
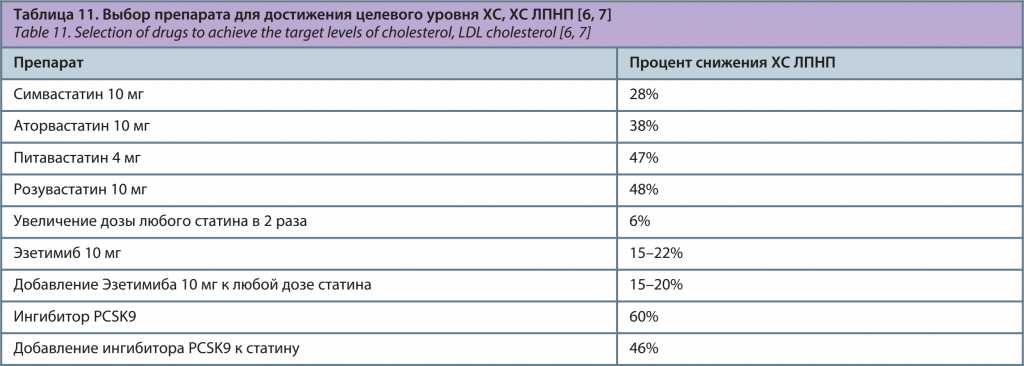
Никотиновая кислота в дозе 2 г/сут снижает ХС ЛПНП на 15–18%, ТГ – на 20–40%, липопротеин (a) – на 30%, повышает ХС ЛПВП на 25% [4]. Но ее длительное применение не может быть рекомендовано больным с инсулинорезистентностью в связи с возможностью этого препарата снижать толерантность к глюкозе, повышать уровень мочевой кислоты и усугублять инсулинорезистентность [5]. После того, как в двух крупных исследованиях были продемонстрированы многочисленные побочные эффекты в отсутствие положительного влияния, препараты данной группы в Европе к применению не рекомендованы [4]. Сравнительная эффективность влияния различных гиполипидемических препаратов на снижение ХС ЛПНП представлена в табл. 11.
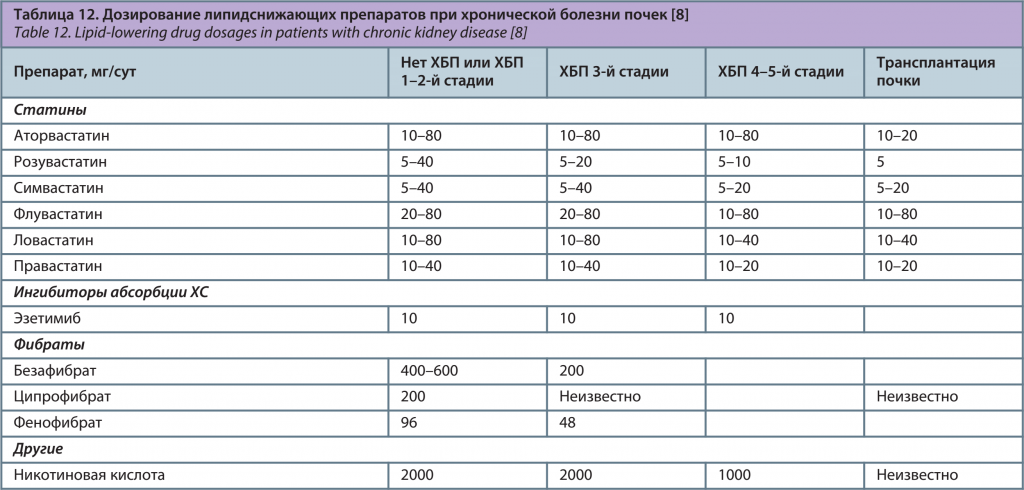
Дозировки отдельных препаратов при КМС представлены с учетом ХБП (табл. 12).
Вторичные дислипидемии
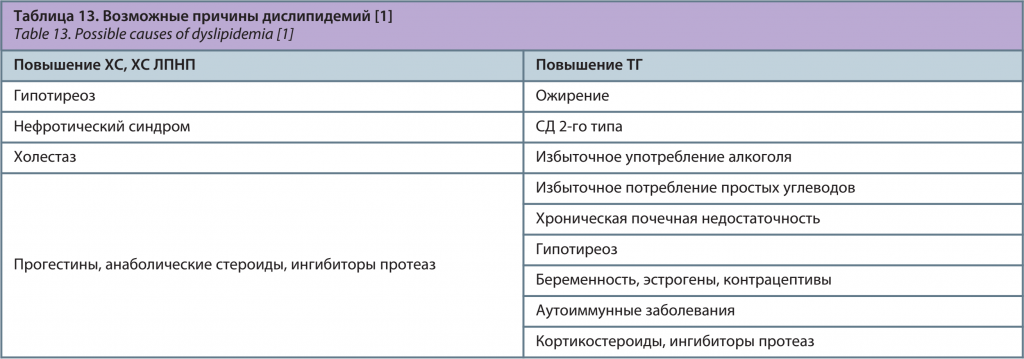
До начала медикаментозной терапии необходимо исключить вторичный характер дислипидемии, при его подтверждении – назначить лечение в соответствии с рекомендациями (табл. 13).
Медикаментозная терапия гипертриглицеридемии. Примерно у 1/2 больных с СД встречаются гипертриглицеридемия или низкий уровень ХС ЛПВП или их сочетание. ХС ЛПНП длительное время может оставаться у них в пределах нормы [4].
Медикаментозную терапию необходимо начинать у пациентов высокого риска с уровнем ТГ>2,3 ммоль/л. Уровень ТГ наиболее эффективно снижают фибраты. Статины несколько менее эффективны у пациентов высокого риска с гипертриглицеридемией. У пациентов с СД 2-го типа с уровнем ТГ>2,3 ммоль/л и ХС ЛПВП<0,8 ммоль/л к терапии статинами рекомендуется добавить фенофибрат [1].
Если уровень ТГ≥5,6 ммоль/л, первоочередной задачей является предупредить развитие панкреатита с помощью фенофибрата, а затем уже решать задачу достижения целевого уровня ХС ЛПНП. Если уровень ТГ не удается контролировать при использовании статинов или фибратов, можно назначить омега-3-ПНЖК в дозе 2–4 г/сут для снижения ТГ [1].
Контроль эффективности и переносимости гиполипидемической терапии
После начала лечения дислипидемии и после изменения режима терапии необходимо контролировать уровень липидов через 4–12 нед, после достижения целевого или оптимального уровня липидов – 1 раз в 6 мес [1].
Уровень аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) на фоне гиполипидемической терапии необходимо определять перед началом лечения, через 4–12 нед после начала или изменения лекарственной терапии. После подбора адекватной терапии рутинный контроль АЛТ/АСТ не рекомендован [1]. Если увеличение АЛТ/АСТ составляет менее трехкратного повышения от верхней границы нормы (ВГН) на фоне гиполипидемической терапии, необходимо продолжить лечение, повторно проверить уровень ферментов через 4–6 нед. Если повышение АЛТ/АСТ составляет более 3 ВГН, необходимо прекратить прием препаратов или снизить дозу и повторно проверить уровень ферментов через 4–6 нед. После нормализации показателей можно вернуться к прежнему режиму лечения. Если уровень ферментов остается повышенным, следует исключить другие возможные причины [1].
Уровень КФК необходимо определять перед началом лечения. Если уровень КФК выше 4 ВГН, лечение начинать нельзя, анализ необходимо повторить. В проведении рутинного контроля КФК нет необходимости. Уровень КФК следует проверить при появлении у пациента миалгии. Особенно часто миалгия вследствие миопатии развивается в возрасте старше 80 лет, при субтильном телосложении, приеме нескольких препаратов, злоупотреблении алкоголем, высокой физической активности, заболеваниях скелетной мускулатуры [1].
При повышении КФК выше 10 ВГН, следует прекратить лечение, проверить функцию почек и проводить контроль каждые 2 нед. Если повышение КФК составляет менее 10 ВГН, при отсутствии симптомов необходимо продолжить гиполипидемическую терапию под контролем уровня КФК. Если повышение КФК составляет менее 10 ВГН, при наличии клинических симптомов следует прекратить гиполипидемическую терапию и контролировать уровень КФК до нормализации, после чего продолжить терапию статинами в более низкой дозе. Если повышение КФК составляет менее 4 ВГН, при наличии симптомов необходимо регулярно контролировать КФК. Если симптомы сохраняются, нужно прервать гиполипидемическую терапию и оценить уровень КФК через 6 нед; пересмотреть показания для лечения статинами, рассмотреть возможность для продолжения лечения тем же или другим статином, рассмотреть возможность низкодозовой терапии статинами, режим приема через день или 1–2 раза в неделю или комбинированную терапию [1].
Заключение
За последние годы в диагностике и лечении дислипидемий достигнуты значительные успехи. Произошел прорыв в разработке новых лекарственных средств на основе моноклональных антител, генно-инженерных технологий, которые обещают внести вклад в снижение СС смертности. Скрининг и коррекцию дислипидемии при КМС необходимо начинать до развития ишемической болезни сердца (стенокардии, ОКС, инфаркта миокарда), СД, инсультов и других серьезных СС событий для снижения смертности и увеличения продолжительности жизни.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
- Ежов М.В., Сергиенко И.В., Аронов Д.М. и др. Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации. VI пересмотр. Атеросклероз и дислипидемии. 2017; 3: 5–22. [Ezhov M.V., Sergienko I.V., Aronov D.M. et al. Diagnostika i korrektsiia narushenii lipidnogo obmena s tsel'iu profilaktiki i lecheniia ateroskleroza. Rossiiskie rekomendatsii. VI peresmotr. Ateroskleroz i dislipidemii. 2017; 3: 5–22 (in Russian).]
- Мамедов М.Н. Метаболический синдром в России. Распространенность, клинические особенности и лечение. М.: Известия, 2011. [Mamedov M.N. Metabolicheskii sindrom v Rossii. Rasprostranennost', klinicheskie osobennosti i lechenie. Moscow: Izvestiia, 2011 (in Russian).]
- Willams B, Mancia G, Spiering W et al. 2018 ESC-ESH Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology (ESC) and the European Society of Hypertension (ESH). Eur Heart J 2018; 39 (33): 3021–04. DOI: 10.1093/eurheartj/ehy339
- ESC/EAS 2016 Guidelines on the management of dyslipidemia. Eur Heart J 2016; 37 (39): 2999–3058. DOI: 10.1093/eurheartj/ehv272
- Рекомендации по ведению больных с метаболическим синдромом. Клинические рекомендации Минздрава России. М., 2013. [Rekomendatsii po vedeniiu bol'nykh s metabolicheskim sindromom. Klinicheskie rekomendatsii Minzdrava Rossii. Moscow, 2013 (in Russian).]
- Weng TC et al. A systematic review and meta-analysis on the therapeutic equivalence of statins. J Clin Pharm Ther 2010; 35: 139–51.
- Mukhtar RY et al. Pitavastatin. Int J Clin Pract 2005; 59 (2): 239–52.
- Моисеев В.С., Мухин Н.А., Смирнов А.В. Сердечно-сосудистый риск и хроническая болезнь почек: стратегии кардио-нефропротекции. Российский кардиологический журнал. 2014, 8 (112): 7–37. [Moiseev V.S., Mukhin N.A., Smirnov A.V. Serdechno-sosudistyi risk i khronicheskaia bolezn' pochek: strategii kardio-nefroprotektsii. Rossiiskii kardiologicheskii zhurnal. 2014, 8 (112): 7–37 (in Russian).]
- Резник Е.В., Шебзухова М.М., Никитин И.Г. Коррекция дислипидемии у больных с метаболическим синдромом: лекция. Справочник поликлинического врача. 2019; 3: 5–14. [Reznik E.V., Shebzukhova M.M., Nikitin I.G. Korrektsiia dislipidemii u bol'nykh s metabolicheskim sindromom: lektsiia. Spravochnik poliklinicheskogo vracha. 2019; 3: 5–14 (in Russian).] Krakauer JC, Krakauer NY et al. ABSI (A Body Shape Index) and ARI (Anthropometric Risk Indicator) in Bariatric Surgery. First Application on a Bariatric Cohort and Possible Clinical Use. Obes Surg 2018; 28 (7): 1966–73. DOI: 10.1007/s11695-018-3117-z
