Ожирение и артериальная гипертензия: механизмы и возможности управления
Ожирение остается одной из глобальных мировых проблем, особенно в связи с выраженной коморбидностью. В данном обзоре мы анализируем связь ожирения и артериальной гипертензии (АГ) как одну из ведущих причин целого каскада неблагоприятных сердечно-сосудистых исходов. В статье рассматриваются патофизиологические механизмы, участвующие в этом процессе: метаболические, гормональные, гемодинамические и почечные изменения. Описано влияние ожирения на тканевой кровоток, сердечный выброс и «резерв» кровотока, отмечено развитие эндотелиальной дисфункции, увеличение артериальной жесткости. Повышенная реабсорбция натрия почками вследствие активации ренин-ангиотензин-альдостероновой системы, активации симпатической нервной системы – одни из важных механизмов развития АГ. Также в статье рассматривается роль некоторых медиаторов, участвующих в генезе АГ при ожирении и современные возможности управления данными коморбидными состояниями с учетом современных знаний, потенциальные перспективы терапевтических подходов.
Ключевые слова: ожирение, артериальная гипертензия, коморбидность, натрийурез, ренин-ангиотензин-альдостероновая система, симпатическая нервная система.
Obesity and arterial hypertension: mechanisms and possibilities of therapy
Abstrаct
Obesity remains global world problem, especially in connection with significant comorbidity. In this review, we analyze the relationship between obesity and arterial hypertension as one of the leading causes of a whole cascade of adverse cardiovascular outcomes. The article discusses the pathophysiological mechanisms involved in this process: metabolic, hormonal, hemodynamic and renal changes. The effect of obesity on tissue blood flow, cardiac output and "reserve" of blood flow is described, the development of endothelial dysfunction, an increase in arterial stiffness are noted. Increased reabsorption of sodium by the kidneys due to activation of the renin-angiotensin-aldosterone system, activation of the sympathetic nervous system are one of the important mechanisms for the development of hypertension. The article also examines the role of some mediators involved in the genesis of hypertension in obesity and modern possibilities of managing these comorbid conditions, taking into account modern knowledge, and the potential prospects of therapeutic approaches.
Key words: obesity, arterial hypertension, comorbidity, natriuresis, renin-angiotensin-aldosterone system, sympathetic nervous system.
For citation: Demidova T.Yu., Gritskevich E.Yu. Obesity and arterial hypertension: mechanisms and possibilities of therapy, FOCUS Endocrinology. 2020; 1: 52–59. DOI: 10.47407/ef2020.1.1.0007
Ожирение остается одной из глобальных мировых проблем, по данным Всемирной организации здравоохранения, названной неинфекционной эпидемией, даже в условиях распространения новой коронавирусной инфекции COVID-19, инфекционной пандемии. Выявлено, что ожирение существенно увеличивает риски осложнений и смерти при COVID-19 [1]. При этом более 1/2 людей с ожирением в мире проживают в 10 странах – США, Китай, Индия, Россия, Бразилия, Мексика, Египет, Германия, Пакистан и Индонезия [2]. Таким образом, Россия, к сожалению, является одним из «лидеров» в ожирении, что подтверждается российскими данными. Исследование ЭССЕ РФ анализировало состояние здоровья лиц в возрасте от 25 до 64 лет, т.е. молодого и среднего, преимущественно трудоспособного возраста. Исследователи пришли к выводу, что распространенность ожирения, по данным индекса массы тела (ИМТ), была среди женщин 30,8%, среди мужчин – 26,9%, по данным окружности талии, среди женщин – 38,4%, среди мужчин – 24,3% [4]. Основной проблемой, связанной с ожирением, является коморбидность и обусловленные этим значительные медицинские расходы. Известно, что пациенты с ожирением чаще обращаются за медицинской помощью, расходы на их лечение на 30% выше в сравнении с лицами без ожирения, а при наличии заболевания, ассоциированного с ожирением, расходы возрастают на 65–113% [4]. По данным российских исследований, выявлено, что ожирение наиболее выражено ассоциировано с повышением уровня глюкозы крови, нарушениями липидного обмена и особенно значимо с артериальной гипертензией (АГ) [5]. Ожирение, несомненно, наиболее частая причина первичной АГ, составляющая, согласно Фрамингемскому исследованию, 65% случаев у женщин с АГ, 78% – у мужчин [6, 7]. Корейские исследователи выявили, что распространенность АГ была прямо пропорциональна повышению ИМТ вне зависимости от возрастной группы: 21,1% мужчин и 13,1% женщин – с ИМТ менее 23 кг/м2, 30,7% мужчин и 27,4% женщин – с ИМТ более 23 кг/м2, 39,6% мужчин и 40,2% женщин – с ИМТ 25–30 кг/м2 (ожирение 1-й степени) и 51,6% мужчин и 49,2% женщин – с ИМТ более 30 кг/м2 (ожирение 2-й степени) соответственно [8]. С учетом стойкого роста распространенности ожирения в России, можно предположить, что этот тандем ожирение – АГ станет одной из ведущих причин целого каскада неблагоприятных сердечно-сосудистых исходов. 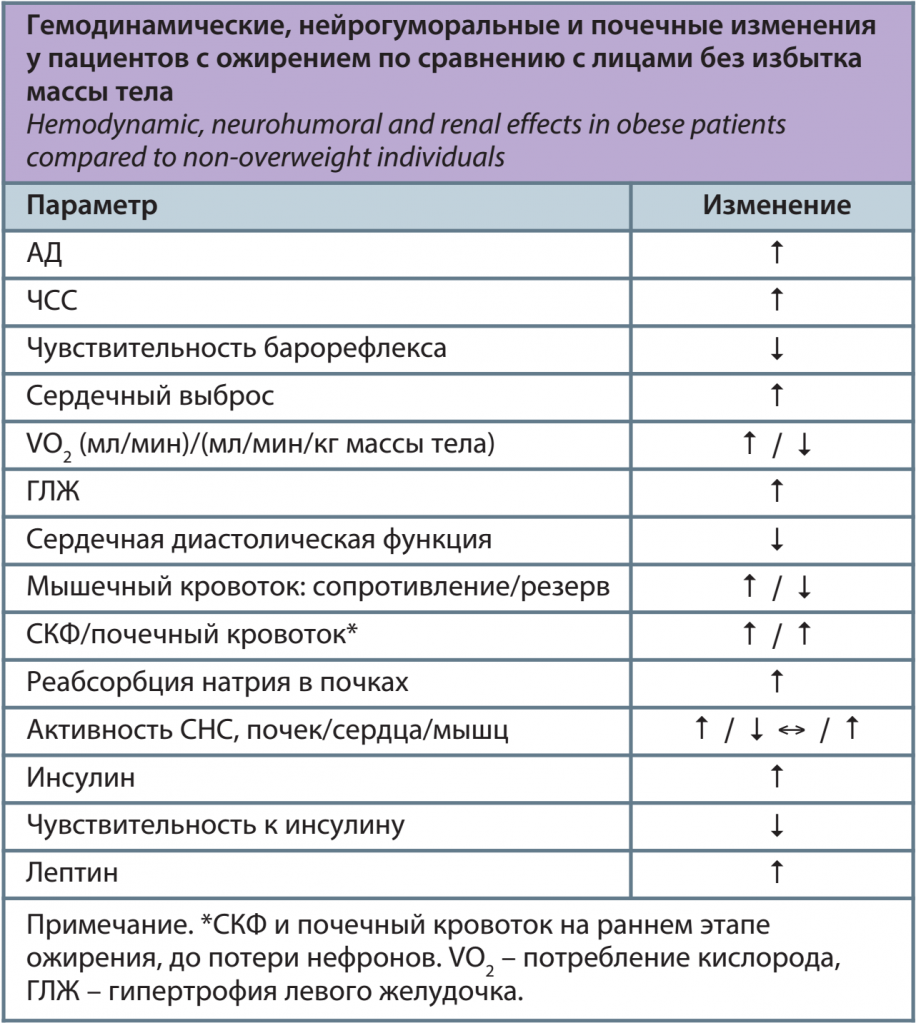
Клинические исследования показывают, что поддержание ИМТ<25 кг/м2 эффективно для первичной профилактики гипертонии и что потеря массы тела снижает артериальное давление (АД) у большинства пациентов с гипертонией [9, 10]. Известно, что не все люди с ожирением страдают АГ, но влияние ожирения на АД во многом зависит от того, как долго человек страдает избыточным весом, прогноз ухудшается с течением времени. Еще одним важным фактором в развитии АГ является перераспределение жира. В большинстве популяционных исследований, изучающих взаимосвязь между ожирением и АД, оценивали ИМТ без оценки висцерального или забрюшинного жира, который, по-видимому, является более значимым предиктором повышения АД, чем подкожный жир [11].
Патофизиологические механизмы, участвующие в этом процессе, сложны и до конца не изучены. Предполагается участие нескольких взаимосвязанных патофизиологических процессов в развитии АГ при ожирении.
Гемодинамические и почечные изменения при артериальной гипертензии, вызванной ожирением
Исследования на экспериментальных животных моделях помогли в понимании сердечно-сосудистых и почечных изменений, связанных с ожирением. Повышение АД с высокой частотой наблюдается при избыточной массе тела, вызванной диетой с высоким содержанием жиров у собак и кроликов. Метаболические, гормональные, сердечно-сосудистые и почечные изменения, вызванные ожирением, на фоне высокожировой диеты у этих экспериментальных животных очень похожи на изменения, наблюдаемые у людей с ожирением (см. таблицу) [12–14]. Некоторые из этих изменений быстро манифестируют при быстром наборе массы тела, а затем нивелируются другими патологическими изменениями. Например, клубочковая гиперфильтрация на ранних стадиях ожирения в последующем сменяется постепенным снижением скорости клубочковой фильтрации (СКФ), поскольку, в связи с длительной гипертензией, развиваются повреждение почек и потеря нефронов [14].
Влияние ожирения на тканевой кровоток, сердечный выброс и «резерв» кровотока
Ожирение связано с увеличением объема внеклеточной жидкости и усилением кровотока во многих тканях, что, в свою очередь, увеличивает венозный возврат и сердечный выброс [13]. Сердечный выброс увеличивается параллельно с увеличением массы тела, и частично это увеличение происходит за счет кровотока, который снабжает избыточную жировую ткань. Однако кровоток увеличивается и в других тканях, таких как сердце, почки, желудочно-кишечный тракт и скелетные мышцы. Часть дополнительного кровотока происходит из-за роста тканей и органов в ответ на повышенную рабочую нагрузку и метаболические потребности, связанные с ожирением. Однако кровоток в тканях, таких как почки, скелетные мышцы и сердце, увеличивается у субъектов с ожирением, даже если поток выражается на грамм массы ткани [15]. Таким образом, ожирение ассоциировано с функциональным расширением сосудов, что, вероятно, связано с повышенной скоростью метаболизма и повышенным потреблением кислорода тканями.
Несмотря на более высокий кровоток в тканях в состоянии покоя, при ожирении наблюдается уменьшенный «резерв» кровотока, который ограничивает рост кровотока, происходящий при физических нагрузках. Это уменьшение резерва кровотока отчасти может быть связано с дисфункцией эндотелия, а снижение массы тела часто улучшает расширение сосудов, опосредованное потоком крови (flow-mediated vasodilation) у лиц с ожирением [16]. При ожирении увеличение артериальной жесткости наблюдается у лиц пожилого, среднего возраста, у молодых людей (20–40 лет) и даже у детей. Более того, более высокая скорость пульсовой волны в аорте, показатель жесткости аорты, сильно коррелирует с увеличением ИМТ, окружности талии и соотношения окружности талии и бедер, независимо от систолического АД, расы и пола [17, 18]. Механизмы, ответственные за негативное влияние ожирения на сосудистую сеть, до конца не выяснены, но, вероятно, связаны с взаимодействием множества факторов, в том числе с повышением АД, воспалением, гипергликемией, «липотоксичностью», вызванной чрезмерным не-β-окислительным метаболизмом жирных кислот, оксидативным стрессом и активацией нейрогуморальных механизмов. Имеются данные о том, что избыток висцерального жира является важным источником цитокинов и других факторов, которые создают оксидативный стресс и воспаление, которые способствуют эндотелиальной дисфункции, жесткости сосудов и, в конечном итоге, атеросклерозу [18].
Ожирение и прессорный натрийурез
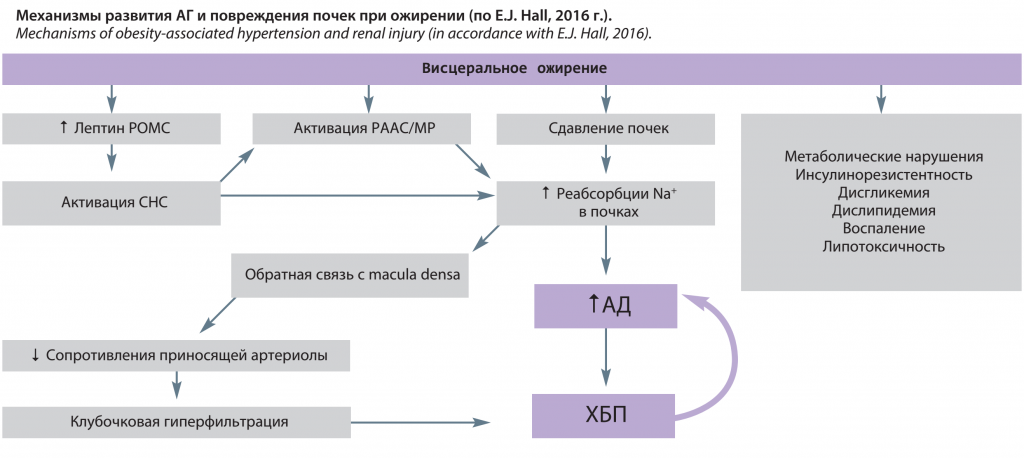
Повышенная реабсорбция натрия почками играет основную роль в инициировании повышения АД, связанного с избыточным набором массы тела. Для поддержания баланса натрия лицам с ожирением требуется более высокое АД, что указывает на нарушение натрийуреза [19]. Предполагают существование трех основных факторов нарушения натрийуретических механизмов во время быстрого избыточного набора массы тела:
1) физическое сдавление почек из-за увеличения висцерального, забрюшинного жира и жировой клетчатки почечных синусов;
2) активация ренин-ангиотензин-альдостероновой системы (РААС), включая активацию минералокортикоидных рецепторов (МР) независимо от альдостерона;
3) активация симпатической нервной системы (СНС), особенно повышенная активность симпатической иннервации почек.
Хроническая болезнь почек (ХБП) может в течение длительного времени усиливать влияние этих механизмов на АД, что затрудняет контроль гипертонии, связанной с ожирением, и ее труднее обратить вспять путем снижения массы тела.
Возможная роль дефицита натрийуретических пептидов в артериальной гипертензии при ожирении
Относительный дефицит натрийуретических пептидов (НУП) также может способствовать нарушению водно-электролитного баланса при АГ у людей с ожирением. Например, лица с ожирением и гипертонией имеют более низкие уровни предсердного НУП, несмотря на более высокое потребление натрия, по сравнению с людьми без избытка массы тела с нормальным давлением [20]. Снижение уровня НУП у пациентов с ожирением сопровождается нарушением ответа на объемную нагрузку [21, 22]. Следовательно, дисфункция системы НУП также может способствовать нарушению гомеостаза соли и воды при ожирении и АГ.
Предсердный НУП принимает участие в метаболической регуляции. У лабораторных мышей с нарушенным клиренсом и повышением уровня НУП и НУП B-типа усилено «коричневение» белых адипоцитов и повышен термогенез [23]. Таким образом, высокие уровни НУП могут защищать от развития ожирения и связанных с ним метаболических нарушений, тогда как дефицит НУП может усугублять метаболические нарушения, вызванные ожирением.
Механическое влияние висцеральной, ретроперитонеальной и почечной жировой клетчатки
Избыточное накопление висцеральной и забрюшинной жировой клетчатки в почках и вокруг них ассоциировано с повышенным внутрипочечным давлением, нарушением натрийуреза и АГ [14]. У пациентов с висцеральным ожирением внутрибрюшное давление повышается пропорционально сагиттальному диаметру брюшной полости. Это высокое внутрибрюшное давление способствует сжатию почечных вен, лимфатических сосудов, мочеточников и почечной паренхимы. У пациентов с ожирением забрюшинная жировая клетчатка часто инкапсулирует почку, плотно прилегает к почечной капсуле и проникает в почечные синусы, вызывая дополнительное сжатие и повышение внутрипочечного давления. В крупных исследованиях, таких как Далласское, Фрамингемское, показана корреляция между паранефральным жиром и АГ, которая сохранялась после поправки на ИМТ и висцеральный жир [24]. Помимо сжатия почек, жир забрюшинного пространства и почечного синуса может способствовать повышению внутриклубочкового давления, развитию воспаления и экспансии внеклеточного матрикса мозгового вещества почек, что может усугубить нарушение функции почек [25–27].
Активация ренин-ангиотензин-альдостероновой системы при ожирении
Повышенная реабсорбция натрия, вызванная компрессией почек, способствует расширению почечных сосудов, клубочковой гиперфильтрации и повышенной секреции ренина у пациентов с ожирением [14]. Усиление реабсорбции натрия в петле Генле снижает доставку NaCl в macula densa и вызывает снижение сопротивления в приносящей артериоле и увеличение почечного кровотока, СКФ и секреции ренина опосредовано через тубулогломерулярную обратную связь (см. рисунок). У пациентов с ожирением, особенно у лиц с висцеральным ожирением, наблюдается повышение активности ренина плазмы, ангиотензиногена, активности ангиотензинпревращающего фермента (АПФ), ангиотензина II (AТ II) и альдостерона [28]. Механизмами активации РААС, как уже было сказано, являются компрессия почек и повышение активации СНС, синтеза компонентов РААС в жировой ткани (ангиотензиногена, АТ II). Активация РААС способствует повреждению клубочков и потере нефронов в связи с сужением эфферентной артериолы под влиянием АТ II, что усугубляет повышение гидростатического давления в клубочках. Исследования с участием пациентов с сахарным диабетом 2-го типа (СД 2) и ожирением показывают, что ингибиторы АПФ или блокаторы рецепторов ангиотензина (БРА) замедляют прогрессирование ХБП [29, 30].
Роль активации минералокортикоидных рецепторов при ожирении
Еще одним фактором развития АГ при ожирении является активация МР. Возможными путями этой активации являются повышение экспрессии в эпителиальных клетках почечных канальцев белка Rac1, который активирует передачу сигнала МР и стимуляцию МР кортизолом [31]. Кортизол имеет высокое сродство к МР, однако почечный эпителий обычно «защищен» ферментом 11β-гидроксистероиддегидрогеназой типа 2 (11β-HSD2), который превращает кортизол в кортизон, глюкокортикоид, который не связывает МР. Однако при ожирении наблюдается подавление активности этого фермента в почках (см. рисунок).
Автономная нервная система и почечные нервы при ожирении
При ожирении наблюдается снижение парасимпатического тонуса и увеличение симпатической нервной активности (СНА). Эти изменения вегетативной активности ассоциированы с увеличением частоты сердечных сокращений (ЧСС), снижением вариабельности ЧСС, снижением барорефлекторной чувствительности, а также с АГ [32]. Повышение ЧСС в основном обусловлено снижением парасимпатического тонуса, а не повышением симпатической активности. Снижение массы тела увеличивает парасимпатический тонус и вариабельность ЧСС, одновременно снижая ЧСС. Висцеральное ожирение характеризуется повышением как мышечной симпатической активности, так и непосредственно почечной симпатической активности. Почечная симпатическая активность стимулирует секрецию ренина и реабсорбцию натрия почками, что способствует развитию и поддержанию гипертонии, вызванной ожирением.
В активации СНС при ожирении предполагается участие нескольких медиаторов:
1) нарушение рефлексов барорецепторов;
2) активация опосредованных хеморецепторами рефлексов, связанных с апноэ во сне и гипоксией;
3) гиперинсулинемия;
4) АТ II;
5) цитокины, высвобождаемые из адипоцитов, такие как лептин, фактор некроза опухоли α и интерлейкин-6;
6) путь проопиомеланокортина (proopiomelanocortin – POMC) в центральной нервной системе (ЦНС).
Хотя роль многих из этих факторов все еще не ясна, лептин и путь POMC в ЦНС, по-видимому, играют важную роль в активации СНС при ожирении в сочетании с АГ.
1. Роль лептина в активации СНС при ожирении и АГ. Вскоре после открытия лептина в 1994 г. исследователи обнаружили положительную связь между концентрацией лептина в плазме и активностью мышечной СНА, а также то, что введение лептина крысам увеличивает активность СНС в коричневой жировой ткани, надпочечниках и почках [33]. Было показано, что хроническое повышение уровня лептина в плазме при выраженном ожирении, вызывает устойчивое повышение АД, которое происходит постепенно, что согласуется с умеренным повышением активности СНС, которого недостаточно, чтобы напрямую вызвать сужение сосудов, но достаточно для увеличения реабсорбции натрия почками. Эффекты лептина на АД устранялись комбинированной блокадой α/β-адренорецепторов. Участки действия лептина в ЦНС – рецепторы лептина экспрессируются во многих областях мозга, включая вентромедиальный гипоталамус, дугообразное ядро и дорсомедиальные области гипоталамуса, а также в вазомоторных центрах ствола мозга и промежуточно-боковых отделах спинного мозга. Хотя центры ЦНС, которые опосредуют действие лептина на активность СНС и сердечно-сосудистую функцию, не были точно картированы, но выявлено, что вовлечены гипоталамические центры и внегипоталамические области, такие как ствол мозга [34]. Поскольку ожирение вызывает глобальную резистентность к лептину, можно ожидать ослабления влияния лептина на активность СНС и АД, а также ослабления его анорексических эффектов.
Другие факторы, связанные с ожирением, такие как эндотелиальная дисфункция и нарушение высвобождения NO, также избирательно усиливают эффекты лептина на активность СНС и АД. Таким образом, ожирение вызывает сложные патофизиологические изменения, которые не только модулируют передачу сигналов рецепторов лептина, но также вызывают изменения в функции почек, сосудов и СНС, которые вносят вклад в неизменное или даже усиленное влияние лептина на активность СНС и АД, тогда как действие лептина на аппетит, расход энергии и гомеостаз глюкозы ослабляется. В совокупности клинические и экспериментальные наблюдения подтверждают роль лептина как связующего звена между ожирением, повышенной активностью СНС и повышенным АД, хотя данные о хронических эффектах лептина на АД у людей все еще ограничены.
2. Роль пути POMC в ЦНС в активации СНС при ожирении и АГ. Путь POMC в ЦНС является основным регулятором аппетита, расхода энергии и массы тела. Нейроны, экспрессирующие POMC, расположены в дугообразном ядре и посылают проекции на нейроны паравентрикулярного ядра и латерального гипоталамуса, где они выделяют α-меланоцит-стимулирующий гормон, агонист рецепторов меланокортина 3/4 (MC3/4R). В дополнение к регулированию энергетического баланса система POMC-MC4R в ЦНС может способствовать активации СНС при ожирении и АГ. Немногочисленные исследования, в которых изучались хронические сердечно-сосудистые действия MC4R в конкретных популяциях нейронов, предполагают роль MC4R на холинергических преганглионарных парасимпатических и симпатических нейронах, способствующих ожирению и гипертензии. Действие MC4R на регуляцию аппетита, расход энергии, активность вегетативной нервной системы и сердечно-сосудистые реакции на стресс, а также многие другие важные функции, возможно, опосредуется через влияние на нейротрофический фактор головного мозга, кортикотропин-рилизинг-гормон, меланин-концентрирующий гормон (MCH) и окситоцин [35]. Возможно, в последующем, основываясь на данных механизмах, будут разработаны новые мишени терапии ожирения и сопутствующей АГ.
Роль хронической болезни почек
Помимо повышения АД за счет компрессии почек и активации РААС и СНС ожирение способствует развитию ХБП, что усугубляет АГ и затрудняет контроль (см. рисунок). СД 2 и АГ, ассоциированные с ожирением, составляют более 70% причин терминальной стадии ХБП. Кроме того, быстрый рост ХБП за последние три десятилетия сопровождался ростом ожирения, и есть доказательства того, что ожирение может быть независимым фактором риска ХБП, помимо его эффектов, способствующих развитию АГ и СД. В исследовании с участием почти 6500 человек, не страдающих СД, увеличение ИМТ и окружности талии было связано со снижением расчетной СКФ и ХБП [36]. Абдоминальное ожирение было связано с более высоким риском почечной недостаточности даже после поправки на дислипидемию, гипергликемию, АД и ИМТ у пациентов с гипертонической болезнью. В ретроспективном анализе 320 252 взрослых, наблюдавшихся в течение 15–35 лет, частота ХБП повышалась ступенчато по мере увеличения ИМТ, и эта взаимосвязь сохранялась после корректировки на АД, диабет, курение, возраст и ряд других переменных [37]. На ранних стадиях развития ожирения и даже у детей с ожирением часто наблюдается интерстициальный фиброз, микроальбуминурия или протеинурия, увеличение мезангиального матрикса, гломеруломегалия, фокальный сегментарный гломерулярный склероз и нарушение подоцитов, связанное с клубочковой гиперфильтрацией. При персистенции ожирения и связанной с ним АГ и метаболических нарушений гиперфильтрация клубочков ослабевает и развивается снижение СКФ, связанное с потерей нефронов. Ожирение также усугубляет последствия других первичных поражений почек, включая одностороннюю нефрэктомию, трансплантацию почки, одностороннюю агенезию почек и нефропатию иммуноглобулина A (IgA). Хотя механизмы, с помощью которых ожирение вызывает повреждение почек, в дополнение к АГ и СД, все еще неясны и выходят за рамки этого обзора, было предложено множество факторов, включая воспаление, митохондриальную дисфункцию, окислительный стресс, дислипидемию и «липотоксичность». Независимо от точных причин ХБП, вызванной ожирением, вполне вероятно, что постепенное снижение функции почек помогает объяснить, почему большинство пациентов с устойчивой к лечению гипертонией также имеют избыточную массу тела или страдают ожирением. При снижении функции почек адекватный контроль АД становится все более сложной задачей.
Особенности управления ожирением в сочетании с артериальной гипертензией
Несмотря на прогрессирующее усугубление проблемы ожирения и АГ, в существующих в настоящее время рекомендациях по лечению АГ ей уделяется совсем мало внимания. К управлению данной проблемой, очевидно, должен быть системный подход с междисциплинарным взаимодействием.
Модификация образа жизни
В рекомендациях American Heart Association / American College of Cardiology (AHA/ACC) от 2019 г. говорится, что все люди с избыточной массой тела / ожирением должны достичь потери веса не менее 5% за 6 мес с помощью гипокалорийной диеты и аэробной физической нагрузки умеренной и высокой интенсивности с целью эффективного снижения АД и профилактики других кардиометаболических нарушений [38]. Это подтверждают результаты исследований, в которых снижение массы тела является самым фундаментальным вмешательством при ожирении и АГ. В исследовании пациентов с метаболическим синдромом снижение массы тела с помощью диеты в сочетании с физической нагрузкой привели к снижению мышечной симпатической активности и чувствительности барорефлекса и АД (все p<0,001) [39]. При сравнении эффективности диеты и физических нагрузок выявлено, что диета оказывает более значимое влияние на «базальный» симпатический тонус [40]. Метаанализ также показывает, что диета с ограничением соли и калорийности DASH (Dietary Approaches to Stop Hypertension) снижает выброс норадреналина, МСНА и АД [41].
Данные NHANES (National Health and Nutrition Examination Surveys) отметили увеличение риска смерти от сердечно-сосудистых заболеваний при диете с высоким содержанием натрия (>2 г в день), красного мяса (>14 г в день) и переработанных углеводов [42]. Исследование PREDIMED отметило значительное снижение систолического АД у пациентов, соблюдающих средиземноморскую диету с добавлением дополнительно оливкового масла первого отжима [43]. Это означает, что ослабление СНА при соблюдении диеты благотворно влияет на АД и снижение смертности.
Применение агонистов глюкагоноподобного пептида-1
Препараты для снижения массы тела могут также способствовать снижению АД. Рандомизированное двойное слепое плацебо-контролируемое исследование SCALE включало 3731 пациента (61,2% имели предиабет) с лишней массой тела или ожирением без доказанного СД 2. Они были случайным образом распределены на группу, получавшую агонист рецептора глюкагоноподобного пептида-1 (ГПП-1) лираглутид 3,0 мг подкожно один раз в день и группу, получавшую плацебо в течение 1 года. В группе лираглутида было отмечено снижение массы тела на 8,4 кг по сравнению с уменьшением массы тела на 2,8 кг в группе плацебо. При этом в группе лираглутида отмечалось снижение АД [44]. В ходе программы исследований SCALE было отмечено, что терапия лираглутидом 3 мг сопровождается снижением показателей систолического АД, окружности талии, общего холестерина и холестерина липопротеидов низкой плотности, увеличением холестерина липопротеидов высокой плотности. Помимо влияния на общее количество жировой ткани, лираглутид уменьшает объем эпикардиального жира, снижает содержание триглицеридов в печени у пациентов с неалкогольным стеатогепатитом, что также способствует снижению кардиометаболического риска.
Бариатрическая хирургия
Доказано, что эффективными стратегиями уменьшения висцеральной, забрюшинной и жировой клетчатки почечного синуса и их неблагоприятного воздействия на сердечно-сосудистую, метаболическую и почечную функцию являются бариатрические операции у пациентов с морбидным ожирением. По современным представлениям, цель бариатрической хирургии – не просто уменьшить массу тела пациента, но также добиться благоприятных метаболических эффектов (нормализация гликемии, липидного обмена, АД). В этой связи большинство современных бариатрических вмешательств объединяются термином «метаболическая хирургия». Бариатрическая/метаболическая хирургия в настоящее время является самым эффективным способом в борьбе с ожирением, существенно сокращает как частоту развития сопутствующих ожирению заболеваний, так и смертность больных и позволяет существенно снизить финансовые затраты на лечение сопутствующих ожирению заболеваний [45]. Однако пока не вполне ясно, какие вмешательства наиболее эффективны и безопасны у пациентов с ожирением и АГ. Необходимы дальнейшие проспективные исследования для определения влияния эктопических жировых отложений в почках и вокруг них на АД и функцию почек и возможности коррекции этих изменений с помощью бариатрических вмешательств.
РААС-направленная терапия
Одним из важнейших подходов к лечению АГ при ожирении является фармакотерапия, регулирующая действие РААС на сосудистый тонус, задержку соли и СНС. Ингибиторы АПФ, как известно, уменьшают AT-II, однако точный механизм подавления СНА пока обсуждается. Ингибиторы АПФ и БРА уменьшают высвобождение норэпинефрина из нервных окончаний путем ингибирования AT-II. Клиническая эффективность ингибиторов АПФ и БРА обусловлена значимой нефропротекцией, обусловленной увеличением экскреции натрия, улучшением эффективного почечного кровотока, снижением внутрипочечного сосудистого сопротивления, нормализацией фильтрационной фракции, уровня альдостерона и среднего АД (p<0,01) [46]. В исследованиях ALLHAT и HOPE ингибиторы АПФ снижали 4-летнюю заболеваемость СД от 8,1 до 3,6% (p<0,001) [47]. В исследованиях LIFE и RENAAL БРА снижали заболеваемость сердечно-сосудистыми заболеваниями/смертность (относительный риск 0,76, 95% доверительный интервал 0,58–0,98, p=0,031) и предотвращали развитие терминальной стадии ХБП на 16% (p=0,02) [48, 49]. Исследование CROSS показало снижение мышечной СНА с 51±12,3 до 40,4±12,5 импульса на 100 ударов сердца (p<0,01) после лечения кандесартаном [50]. Таким образом, РААС-направленная терапия необходима для подавления избыточной СНА, которая является одним из ведущих механизмов развития АГ при ожирении (см. рисунок).
Блокаторы минералокортикоидных рецепторов
Блокаторы МР являются важным терапевтическим инструментом для снижения АД и уменьшения повреждения органов-мишеней при ожирении и АГ, особенно в условиях развития хронической сердечной недостаточности. Прием антагонистов МР обеспечивает значительный антигипертензивный эффект у резистентных к лечению пациентов с ожирением, хотя не было выявлено корреляции между уровнями альдостерона в плазме и ответом АД на блокаду МР. Антагонизм в отношении МР снижает клубочковую гиперфильтрацию, может иметь важное значение для нефропротекции. Снижение АД при применении блокаторов МР у пациентов с ожирением и резистентной гипертензией происходило, несмотря на одновременную терапию ингибиторами АПФ или БРА, что позволяет предположить, что активация МР при ожирении может происходить независимо от AТ II-опосредованной стимуляции секреции альдостерона. Пока недостаточно ясно, почему блокаторы МР так эффективны для снижения АД при ожирении даже при отсутствии гиперальдостеронизма, особенно у пациентов, принимающих ингибиторы АПФ или БРА. Одно из объяснений состоит в том, что ожирение увеличивает чувствительность к активации МР, опосредованной альдостероном.
Почечная денервация
Три крупных исследования сообщили о значительном снижении АД при почечной денервации по сравнению с имитацией процедуры у пациентов с АГ и резистентной АГ [51, 52]. У собак с АГ и ожирением показано, что почечная денервация очень эффективно снижает АД за счет уменьшения почечной СНА и увеличения экскреции натрия. Почечная денервация не считается потенциально опасной процедурой, но сообщения о стенозе почечной артерии после данной процедуры, предположительно вызванном повреждением эндотелия радиочастотными катетерами, используемыми для абляции почечных нервных волокон, делает дискутабельным широкое внедрение данного вмешательства.
Терапия, направленная на активацию барорецепторов
Система Barostim Neo, одобренная Управлением США по контролю пищевых продуктов и лекарств (FDA), включает генератор импульсов, имплантируемый под ключицу, и проводник, присоединенный к стенке сонной артерии. После того как устройство имплантировано, врач тестирует и программирует его. Система активирует барорецепторы, расположенные в стенке сонной артерии. В ответ на активацию мозг модулирует эфферентные пути, которые расслабляют кровеносные сосуды, замедляют частоту сердечных сокращений и препятствуют выработке гормонов, связанных со стрессом, уменьшают симптомы сердечной недостаточности [53].
Заключение
Имеются неопровержимые доказательства того, что избыточная масса тела и висцеральное ожирение являются основными причинами АГ, на которые, возможно, приходится 65–75% риска гипертонической болезни у человека. Хотя механизмы гипертонии, вызванной ожирением, все еще интенсивно изучаются, исследования на экспериментальных животных и людях предполагают важную роль нарушения натрийуреза, повышения давления на ткани почки вследствие механического сжатия окружающей жировой клетчаткой и активации РААС и СНС. Поскольку ожирение и его метаболические и гемодинамические последствия сохраняются в течение многих лет, повреждение почек постепенно делает гипертензию более тяжелой и более устойчивой к терапии.
Потеря массы тела эффективна для лечения АГ, однако многие пациенты с ожирением не могут добиться адекватной потери веса и поддерживать массу тела за счет изменения образа жизни. Использование лекарственных препаратов, бариатрических операций и процедур, обеспечивающих адекватную долгосрочную потерю массы тела, способствует лучшему контролю АГ. Таким образом, современные терапевтические подходы нацелены в основном на лечение гипертонии и метаболических последствий ожирения, включая СД, дислипидемию и воспаление. В дополнение к рекомендациям по снижению массы тела необходимы специальные рекомендации по лечению гипертонии, связанной с ожирением.
Самой важной терапевтической целью для пациентов с ожирением и гипертонией должно быть устранение основных причин ожирения. Однако физиологические и поведенческие факторы, регулирующие энергетический баланс, все еще недостаточно изучены, несмотря на бурный рост исследований, связанных с ожирением, за последние два десятилетия и открытие многих адипокинов, желудочно-кишечных гормонов и путей ЦНС, которые влияют на потребление пищи и расход энергии. К сожалению, одни из ведущих механизмов, контролирующих энергетический баланс, такие как лептин и меланокортиновая система, также имеют тенденцию повышать АД и ЧСС. Необходимы дальнейшие исследования для лучшего понимания молекулярных путей, которые связывают метаболическую и сердечно-сосудистую регуляцию. Возможно, в ближайшем будущем будут разработаны более эффективные методы лечения ожирения и, следовательно, контроля АД у таких пациентов.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Литература / References
- Petrilli CM, Jones SA, Yang J et al. Factors associated with hospitalization and critical illness among 4,103 patients with COVID-19 disease in New York City. medRxiv 2020; 2020.04.08.20057794. DOI: 10.1101/2020.04.08.20057794
- Ng M, Fleming T, Robinson M et al. Global, regional, and national prevalence of overweight and obesity in children and adults during 1980–2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet 2014; 384 (9945): 766–81. DOI: 10.1016/S0140-6736(14)60460-8
- Баланова Ю.А., Шальнова С.А., Деев А.Д и др.; от имени участников исследования ЭССЕ-РФ. Ожирение в российской популяции – распространенность и ассоциации с факторами риска хронических неинфекционных заболеваний. Российский кардиологический журнал. 2018; 23 (6): 123–30. DOI: 10.15829/1560-4071-2018-6-123-130 [Balanova Iu.A., Shal'nova S.A., Deev A.D et al.; ot imeni uchastnikov issledovaniia ESSE-RF. Ozhirenie v rossiiskoi populiatsii – rasprostranennost' i assotsiatsii s faktorami riska khronicheskikh neinfektsionnykh zabolevanii. Rossiiskii kardiologicheskii zhurnal. 2018; 23 (6): 123–30. DOI: 10.15829/1560-4071-2018-6-123-130 (in Russian).]
- Withrow D, Alter DA. The economic burden of obesity worldwide: A systematic review of the direct costs of obesity. Obesity Rev 201112, 2: 131–41. DOI: 10.1111/j.1467-789X.2009.00712.x
- Остроумова О.Д., Кочетков А.И., Копченов И.И., Фомина В.М. Артериальная гипертония в сочетании с избыточной массой тела и ожирением. Возможности комбинации амлодипина и лизиноприла. Часть 2. Антигипертензивные и органопротективные эффекты фиксированной комбинации амлодипин/лизиноприл у больных с артериальной гипертонией в сочетании с избыточной массой тела и ожирением. Рациональная фармакотерапия в кардиологии. 2017; 13 (6): 841–50. DOI: 10.20996/1819-6446-2017-13-6-841-850 [Ostroumova O.D., Kochetkov A.I., Kopchjonov I.I., Fomina V.M. Arterial hypertension in the presence of overweight and obesity. the capabilities of amlodipine and lisinopril combination. Part 2. Antihypertensive and Organoprotective Effects of Amlodipine/Lisinopril Fixed-Dose Combination in Patients with Arterial Hypertension in the Presence of Overweight and Obesity. Rational Pharmacotherapy in Cardiology. 2017; 13 (6): 841–50. DOI: 10.20996/1819-6446-2017-13-6-841-850 (in Russian).]
- Hall JE, do Carmo JM, da Silva AA et al. Obesity-induced hypertension. Circ Res 2015; 116: 991–1006.
- Garrison RJ, Kannel WB, Stokes J, Castelli WP. Incidence and precursors of hypertension in young adults: the Framingham Offspring Study. Prev Med 1987; 16: 235–51.
- Lee HS, Park Y-M, Han K et al. Abstract P268: impact of overweight and obesity in prevalence and management of hypertension. Circulation 2017; 135 (Suppl. 1): A268–A1268.
- Jones DW, Miller ME, Wofford MR et al. The effect of weight loss intervention on antihypertensive medication requirements in the hypertension Optimal Treatment (HOT) study. Am J Hypertens 1999; 12: 1175–80.
- Stevens VJ, Obarzanek E, Cook NR et al. Long-term weight loss and changes in blood pressure: results of the Trials of Hypertension Prevention, phase II. Ann Intern Med 2001; 134: 1–11.
- Tchernof A, Despres JP. Pathophysiology of human visceral obesity: an update. Physiol Rev 2013; 93: 359–404.
- Hall JE. The kidney, hypertension, and obesity. Hypertension 2003; 41: 625–33.
- Hall JE, Brands MW, Dixon WN, Smith MJ Jr. Obesity-induced hypertension. Renal function and systemic hemodynamics. Hypertension 1993; 22: 292–9.
- Hall ME, do Carmo JM, da Silva AA еt al. Obesity, hypertension, and chronic kidney disease. Int J Nephrol Renovasc Dis 2014; 7: 75–88.
- Carroll JF, Huang M, Hester RL et al. Hemodynamic alterations in hypertensive obese rabbits. Hypertension 1995; 26: 465–70.
- Raitakari M, Ilvonen T, Ahotupa M et al. Weight reduction with very-low-caloric diet and endothelial function in overweight adults: role of plasma glucose. Arterioscler Thromb Vasc Biol 2004; 24: 124–8.
- Wildman RP, Mackey RH, Bostom A et al. Measures of obesity are associated with vascular stiffness in young and older adults. Hypertension 2003; 42: 468–73.
- Lyon CJ, Law RE, Hsueh WA. Minireview: adiposity, inflammation, and atherogenesis. Endocrinology 2003; 144: 2195–200.
- Hall JE. Mechanisms of abnormal renal sodium handling in obesity hypertension. Am J Hypertens 1997; 10: 49S–55S.
- Asferg CL, Nielsen SJ, Andersen UB et al. Relative atrial natriuretic peptide deficiency and inadequate renin and angiotensin II suppression in obese hypertensive men. Hypertension 2013; 62: 147–53.
- Wang TJ, Larson MG, Levy D et al. Impact of obesity on plasma natriuretic peptide levels. Circulation 2004; 109: 594–600.
- Savoia C, Volpe M, Alonzo A et al. Natriuretic peptides and cardiovascular damage in the metabolic syndrome: molecular mechanisms and clinical implications. Clin Sci (Lond) 2010; 118: 231–40.
- Bordicchia M, Liu D, Amri EZ et al. Cardiac natriuretic peptides act via p38 MAPK to induce the brown fat thermogenic program in mouse and human adipocytes. J Clin Invest 2012; 122: 1022–36.
- Foster MC, Hwang SJ, Porter SA et al. Fatty kidney, hypertension, and chronic kidney disease: the Framingham Heart Study. Hypertension 2011; 58: 784–90.
- Dwyer TM, Banks SA, Alonso-Galicia M et al. Distribution of renal medullary hyaluronan in lean and obese rabbits. Kidney Int 2000; 58: 721–9.
- Alonso-Galicia M, Dwyer TM, Herrera GA, Hall JE. Increased hyaluronic acid in the inner renal medulla of obese dogs. Hypertension 1995; 25: 888–92.
- Hall JE, Brands MW, Henegar JR. Mechanisms of hypertension and kidney disease in obesity. Ann NY Acad Sci 1999; 892: 91–107.
- Engeli S, Sharma AM. The renin-angiotensin system and natriuretic peptides in obesity-associated hypertension. J Mol Med (Berl) 2001; 79: 21–9.
- Lewis EJ, Hunsicker LG, Clarke WR et al. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Engl J Med 2001; 345: 851–60.
- Brenner BM, Cooper ME, de ZD, Keane WF et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med 2001; 345: 861–9.
- Fujita T. Mechanism of salt-sensitive hypertension: focus on adrenal and sympathetic nervous systems. J Am Soc Nephrol 2014; 25:1148–55.
- Lohmeier TE, Iliescu R. The sympathetic nervous system in obesity hypertension. Curr Hypertens Rep 2013; 15: 409–16.
- Machleidt F, Simon P, Krapalis AF et al. Experimental hyperleptinemia acutely increases vasoconstrictory sympathetic nerve activity in healthy humans. J Clin Endocrinol Metab 2013; 98: E491–E496.
- Mark AL. Selective leptin resistance revisited. Am J Physiol Regul Integr Comp Physiol 2013; 305: R566–R581.
- Girardet C, Butler AA. Neural melanocortin receptors in obesity and related metabolic disorders. Biochim Biophys Acta 2014; 1842: 482–94.
- Burton JO, Gray LJ, Webb DR, et al. Association of anthropometric obesity measures with chronic kidney disease risk in a non-diabetic patient population. Nephrol Dial Transplant 2012; 27: 1860–6.
- Hsu CY, McCulloch CE, Iribarren C et al. Body mass index and risk for end-stage renal disease. Ann Intern Med 2006; 144: 21–8.
- Arnett DK, Blumenthal RS, Albert MA et al. 2019 ACC/AHA guideline on the primary prevention of cardiovascular disease: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation 2019; 140: e596–e646.
- Toschi-Dias E, Rondon MU, Maki-Nunes C et al. Abstract 12647: effects of diet and exercise training on sympathetic hyperactivation and baroreflex sensitivity in patients with metabolic syndrome and obstructive sleep apnea. Circulation 2011; 124 (Suppl. 21): A12647.
- Straznicky NE, Lambert EA, Nestel PJ et al. Sympathetic neural adaptation to hypocaloric diet with or without exercise training in obese metabolic syndrome subjects. Diabetes 2010; 59: 71–9.
- Saneei P, Salehi-Abargouei A, Esmaillzadeh A, Azadbakht L. Influence of Dietary Approaches to Stop Hypertension (DASH) diet on blood pressure: a systematic review and meta-analysis on randomized controlled trials. Nutr Metab Cardiovasc Dis 2014; 24: 1253–61.
- Micha R, Peñalvo JL, Cudhea F et al. Association Between dietary factors and mortality from heart disease, stroke, and type 2 diabetes in the United States. JAMA 2017; 317: 912–24.
- Estruch R, Ros E, Salas-Salvado J et al. Primary prevention of cardiovascular disease with a Mediterranean diet supplemented with extra-virgin olive oil or nuts. N Engl J Med 2018; 378: e34.
- Pi-Sunyer X, Astrup A, Fujioka K et al. A Randomized, Controlled Trial of 3.0 mg of Liraglutide in Weight Management. N Engl J Med 2015; 373 (1): 11–22. DOI: 10.1056/NEJMoa1411892
- Mechanick J, Youdim A, Jones DB et al. American Association of Clinical Endocrinologists, Obesity Society, American Society for Metabolic & Bariatric Surgery. Clinical practice guidelines for the perioperative nutritional, metabolic, and nonsurgical support of the bariatric surgery patient-2013 update: cosponsored by American Association of Clinical Endocrinologists, the Obesity Society, and American Society for Metabolic & Bariatric Surgery. Endocr Pract 2013; 19 (2): 337–72.
- Sanchez RA, Marco E, Gilbert HB et al. Natriuretic effect and changes in renal haemodynamics induced by enalapril in essential hypertension. Drugs 1985; 30 (Suppl. 1): 49–58.
- Weber MA. The ALLHAT report: a case of information and misinformation. J Clin Hypertens (Greenwich) 2003; 5: 9–13.
- Sharma M. The RENAAL study investigation. Clin Diabetes 2002; 20: 19–20.
- Katsiki N, Tsioufis K, Ural D, VolpeM. Fifteen years of LIFE (Losartan Intervention for Endpoint Reduction in Hypertension)–Lessons learned for losartan: An “old dog playing good tricks”. J Clin Hypertens 2018; 20: 1153–9
- Grassi G, Seravalle G, Dell’Oro R et al. Comparative effects of candesartan and hydrochlorothiazide on blood pressure, insulin sensitivity, and sympathetic drive in obese hypertensive individuals: results of the CROSS study. J Hypertens 2003; 21: 1761–9.
- Kandzari DE, Bo¨hm M, Mahfoud F et al. Effect of renal denervation on blood pressure in the presence of antihypertensive drugs: 6-month efficacy and safety results from the SPYRAL HTN-ON MED proof-of-concept randomized trial. Lancet 2018; 391: 2346–55.
- Azizi M, Schmieder RE, Mahfoud F et al. Endovascular ultrasound renal denervation to treat hypertension (RADIANCE-HTN SOLO): a multicentre, international, single-blind, randomised, sham-controlled trial. Lancet 2018; 391: 2335–45.
- de Leeuw PW, Bisognano JD, Bakris GL et al. Sustained reduction of blood pressure with baroreceptor activation therapy. Hypertension 2017; 69: 836–43.
